БРОНХОАЛЬВЕОЛЯРНЫЙ ЛАВАЖ ПОКАЗАНИЯ. ТЕХНИКА. ОСЛОЖНЕНИЯ
Автор (ы): С.К. Собакина, П.В. Белокопытов, А.Н. Лапшин, С.Г. Атанасова, А.А. Иванова
Организация(и): Инновационный ветеринарный центр Московской ветеринарной академии
Журнал: №5 - 2018
УДК 619:616.24
Ключевые слова: бронхоальвеолярный лаваж, бронхоальвеолы, бронхоскопия. Key words: bronchoalveolar lavage, bronchoalveoli, bronchoscopy/
Сокращения: БАЛ – бронхоальвеолярный лаваж, ПАВ – поверхностно-активное вещество
Цель исследования: описать существующие техники проведения бронхоальвеолярного лаважа
Абстракт
Бронхоальвеолярный лаваж (БАЛ) – это минимально инвазивная техника, используемая в гуманной и ветеринарной медицине для отбора проб из бронхов нижнего порядка и альвеолярных пространств.
Отбор проб БАЛ используется для изучения врожденного, клеточного и гуморального клеточного ответа, обусловленного наличием популяции клеток, которые могут облегчить диагностику различных диффузных заболеваний легких.
Бронхоскопия и БАЛ могут предоставить диагностически ценную информацию в случаях воспалительных заболеваний дыхательных путей, бронхоэктазии, эозинофильной пневмонии, паразитарных заболеваний легких, бактериальной пневмонии, микотической пневмонии и неоплазии [1,2,3,16].
Summary
Bronchoalveolar lavage (BAL) is a minimally invasive technique utilized in human and veterinary medicine to sample the lower generation bronchi and alveolar spaces.
BAL sampling is used to study the congenital, cellular and humoral cellular response due to the presence of a cell population caused by the presence of a population of cells that can facilitate the diagnosis of various diffuse pulmonary diseases.
Bronchoscopy and BAL can provide definitive diagnoses in cases of inflammatory airway disease, bronchiectasis, eosinophilic pneumonia, pulmonary parasites, bacterial pneumonia, mycotic pneumonia and neoplasia.
Показанием для проведения БАЛ являются кашель, неясные или отсутствие изменений на рентгенограмме легких, несмотря на проявление клинических признаков, соответствующих заболеваниям респираторного тракта, новообразования легких, пневмония, стридор, удаление обструкции бронхиальной слизью.
Противопоказаниями к проведению БАЛ являются одышка (относительное противопоказание) и коагулопатия.
Есть несколько критериев, гарантирующих попадание раствора в нижние дыхательные пути (бронхоальвеолы): процент извлекаемой жидкости и наличие слоя ПАВ. [2]
Более высокий процент извлеченного раствора (около 50%) говорит об отборе проб из нижних дыхательных путей. Медиана извлеченного раствора у собак 42-48%, у кошек 50-75%. В свою очередь, небольшое количество извлеченной жидкости (< 40%) говорит о том, что проба взята из крупных дыхательных путей [19].
Поверхностно-активное вещество (ПАВ) – это фосфолипиды, белки и ионная смесь, секретируемая пневмоцитами типа II в эпителиальную альвеолярную поверхность для снижения альвеолярного поверхностного натяжения. Поскольку легочное поверхностно-активное вещество в дыхательных путях присутствует только в альвеолярной эпителиальной выстилке, присутствие ПАВ в БАЛ подтверждает, что отбор проб был произведен именно из альвеол. В пробах БАЛ ПАВ проявляется в виде пены (рис. 1).
 Рис. 1. Присутствие ПАВ в образце жидкости БАЛ
Рис. 1. Присутствие ПАВ в образце жидкости БАЛ
Цитологический анализ остается основой оценки БАЛ. В норме у здорового животного в БАЛ содержатся макрофаги, лимфоциты, нейтрофилы, эозинофилы и тучные клетки.
Образцы жидкости БАЛ считаются неприемлемыми, если они были загрязнены из других областей дыхательных путей или не представляют собой бронхоальвеолярную среду [23].
Техника проведения БАЛ
Основная техника БАЛ включает в себя вливание стерильного изотонического раствора в нижние дыхательные пути и аспирацию этого раствора. БАЛ может быть проведен вслепую, путем проведения катетера в легкие через эндотрахеальную трубку, с бронхоскопической ассистенцией или под контролем рентгеноскопии. Бронхоскопически-ассистированный БАЛ позволяет визуализировать нижние дыхательные пути и направлять БАЛ в наиболее пораженные доли легких [2,22].
Проведение БАЛ у собак
Заболевание нижних дыхательных путей у собак приводит к структурным изменениям в бронхах (например, утолщение слизистой оболочки, повышенная экссудация) и изменениям в нормальной популяции клеток эпителиальной выстилки [23].
БАЛ у собак проводится под общей анестезией. Пациентам, проходящим процедуру БАЛ, рекомендуется поддержка оксигенотерапии во время и некоторое время после проведения процедуры, пока сатурация не придет к норме [14].
Во время проведения «слепого» БАЛ перорально в трахею через стерильную эндотрахеальную трубку вводится стерильный уретральный катетер до тех пор, пока он осторожно не вклинится в дистальный бронх, почувствовав при этом сопротивление. Необходимо проявлять осторожность, чтобы не завести катетер слишком далеко в дыхательные пути и не спровоцировать ятрогенный пневмоторакс, повредив ткань легкого трансбронхиально. После введения от трех до пяти раз вводится 25 мл или 5 мл/кг (по разным данным) теплого (37 С) стерильного изотонического раствора сразу же проводится аспирация( транстрахеальный смыв) и затем проводится 2-3 мануальных вдоха мешком Амбу. После этого остаток жидкости аспирируется самотеком или с помощью аспиратора. Иногда подниманием задней части животного можно увеличить количество извлекаемой жидкости (рис. 2).
 Рис. 2. Поднятие задней части тела животного для увеличения количества извлекаемой жидкости
Рис. 2. Поднятие задней части тела животного для увеличения количества извлекаемой жидкости
Данный метод БАЛ зачастую обеспечивает лаваж каудальных долей легких (рис. 3) [4,6,13].
 Рис. 3. Набор инструментов для проведения БАЛ
Рис. 3. Набор инструментов для проведения БАЛ
Во время бронхоскопического БАЛ бронхоскоп вводится перорально в трахею. До выполнения БАЛ проводится полное бронхоскопическое обследование. Как только участок лаважа идентифицирован, бронхоскоп осторожно вклинивается в субсегментный бронх. Плотное прилегание бронхоскопа к исследуемому бронху обеспечивает максимальное извлечение введенного раствора. Когда достигнуто плотное прилегание к бронху, через биопсийный канал бронхоскопа вводится теплый (37С°) изотонический раствор. Рекомендуется введение теплого изотонического солевого раствора для снижения риска возникновения бронхоспазма. От 1 до 4 раз вводится в общей сумме от 5 до 50 мл раствора (1-2 мл/кг). Проведенные исследования обнаружили, что использование объема в расчете мл/кг веса приводит к большему объему извлеченной жидкости. Введение небольшого количества раствора может быть недостаточным для достижения альвеол. После того, как физиологический раствор был введен в дыхательные пути, происходит немедленная аспирация при помощи шприца или с помощью аспиратора, соединенного последовательно с аспирационным клапаном бронхоскопа или с уретральным катетером через стерильную пробирку для сбора проб. Отсутствие раствора при аспирации может быть из-за коллапса дыхательных путей и следует накладывать меньше усилий на шприц для аспирации. Если отрицательное давление все еще присутствует, бронхоскоп можно быть оттянут на несколько миллиметров, но в этом случае объем полученной жидкости может быть меньше. Рекомендуется отбирать пробы БАЛ из нескольких долей легких даже при диффузном поражении легких. Пациентам с очаговыми поражениями легких (аспирационная пневмония) следует выполнять БАЛ только из пораженной доли легкого. Если получен недостаточный объем раствора или если нет пены, процедуру следует повторить [4,6,13,14,23].
Исследования гуманной медицины показало, что бронхоскопически-ассистированный БАЛ обеспечивает образцами более высокого диагностического качества и надежности, чем неконтролируемая техника [10]. Но особенностью и особым вниманием, которое надо проявлять к применению данной техники в ветеринарной медицине, по нашему мнению, является сложность в подготовке инструментального канала к исследованию для исключения контаминации флорой инструментального канала бронхоскопа образцов БАЛ.
Проведение БАЛ у кошек
 Рис. 4. Проведение БАЛ кошке
Рис. 4. Проведение БАЛ кошке
Меньший размер респираторного тракта у кошек делает бронхоскопию трудной. С этим связано большее количество осложнений по сравнению с другими видами животных. Например, в ретроспективном обзоре гибкой бронхоскопии и БАЛ у кошек в ветеринарном центре выявлено 38% осложнений по сравнению с 5% у людей. Большинство (24%) осложнений в этом обзоре считаются умеренными (например, десатурация гемоглобина). Рекомендуется предварительное введение ингаляционных бронходилататоров (сальбутамол, ипратропия бромид) перед БАЛ у кошек. БАЛ у кошек проводится аналогично с БАЛ у собак. Объем вводимого раствора варьируется до 20 мл или 3-5 мл/кг, чаще всего достаточно 2-3 введений (рис. 4) [10, 19, 24].
Проведенные исследования, сравнивающие 2 метода аспирации: мануальный и при помощи отсоса, показали, что аспирация посредством отсоса дает большее количество аспирируемой жидкости и более качественные образцы, однако это не влияет на окончательные результаты анализа БАЛ [16,21].
Рентгеноскопически-ассистированный БАЛ
В ретроспективном исследовании проведен рентгеноскопически-ассистированный БАЛ кошкам. Интубированному пациенту вводился 0,035“ гидрофильный проводник, по которому вводился 8Fr красный резиновый катетер. БАЛ проведен посредством двукратного введения 5 мл стерильного физиологического раствора, который был аспирирован 20 мл шприцом. В результате проведения рентгеноскопически-ассистированного БАЛ только катетеризация краниальной правой доли легких закончилась безуспешно, катетеризация остальных долей легких проведена успешно, результаты цитологического анализа отвечали всем необходимым требованиям. Следовательно, рентгеноскопически-ассистированный БАЛ может являться практичной, надежной и безопасной методикой для отбора проб из всех долей легких, кроме краниальной правой доли (рис. 5, 6) [24].
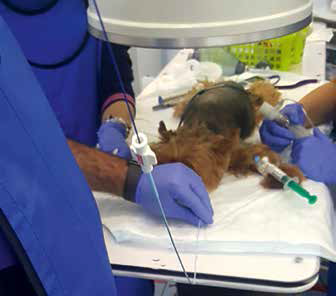
Рис. 5. Проведение рентгеноскопически-ассистированного БАЛ собаке
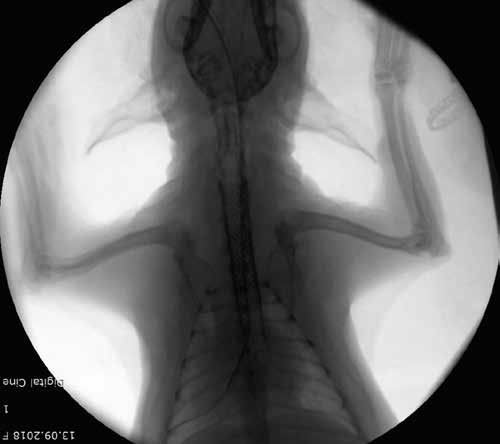
Рис. 6. Визуализация при рентгеноскопии во время проведения БАЛ
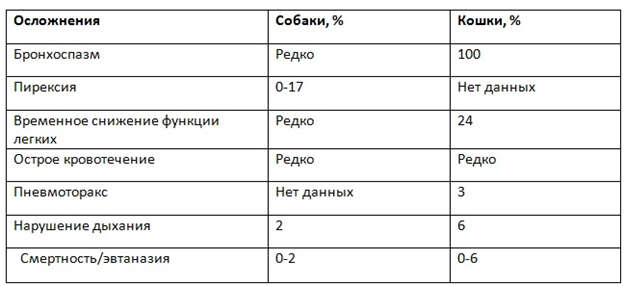
Побочные эффекты и осложнения после проведения БАЛ
Незначительные осложнения могут включать кровотечение, стойкую гипоксемию, бронхоспазм и вазовагальный обморок. Основные осложнения включают пневмонию, аритмии, пневмоторакс, пневмомедиастинум, дыхательную недостаточность и остановку сердца [18].
Всем пациентам после проведения БАЛ необходима дополнительная оксигенация. Если отмечается цианоз или снижение сатурации, необходима дополнительная оксигенация. Если пациенту не достаточно дополнительной оксигенации, следует рассмотреть другие причины, такие как бронхоспазм или пневмоторакс. Также после любой процедуры лаважа может быть временное ухудшение дыхательной функции или кашель [16].
Сообщается о случаях спонтанного пневмоторакса. Редко, но осложнения после проведения БАЛ могут быть фатальными, такие пациенты либо имели респираторный дистресс-синдром до проведения БАЛ, либо было невозможно восстановить адекватную оксигенацию и вентиляцию после процедуры [20].
Сообщается о 2% показателе смертности/эвтаназии (2/101). В этом исследовании смертность связана с предшествующим процедуре БАЛ респираторным дистресс-синдромом. Данные находки приводят к выводу, что предшествующая одышка является относительным противопоказанием к проведению БАЛ. Также сообщается о значительном бронхоспазме после проведения БАЛ у собак с эозинофильными заболеваниями дыхательных путей, который купировался при помощи бронходилататоров и оксигенации . В ретроспективном обзоре гибкой бронхоскопиии БАЛ у кошек сообщается о том, что 6% кошек требовалась ночная госпитализация и проведение оксигенотерапии, у 3% развился пневмоторакс и у 6% смертность или эвтаназия были связана с невозможностью восстановления вентиляции после процедуры. Зарегистрировано значительно меньше осложнений у кошек, которые предварительно получили тербуталин 0,01 мг/кг п/к за 12-24 час. перед проведением бронхоскопии и БАЛ (8%) по сравнению с кошками, которые предварительно ничего не получали (40%). Предварительное получение ингаляционных бронходилататоров (сальбутамол, ипратропия бромид) перед БАЛ предупреждает бронхоконстрикцию у аллерген-чувствительных кошек. Таким образом, в настоящее время рекомендуется предварительное получение бронходилататоров перед бронхоскопией у кошек [15, 21, 22].
Анализ жидкости БАЛ
Для достижения наилучших результатов обработка образцов БАЛ должна выполняться в течение часа после сбора. При оценке цитологии следует оценивать пробы лаважа с каждой доли в отдельности. В одном из исследований 37% собак имели разные результаты, когда оценивали образцы из разных легочных долей.
В каждом образце необходимо подсчитать не менее 200 клеток. Наиболее распространенным типом клеток, выделенным в БАЛ, является альвеолярный макрофаг. Жидкость БАЛ кошек в норме содержит большее количество эозинофилов по сравнению с другими видами [17].
Большинство собак с бактериальными инфекциями имеют нейтрофильное воспаление. У собак с хроническим бронхитом чаще всего наблюдается смешанное воспалительное или нейтрофильное воспаление. Увеличение количества эозинофилов (от 20% до 450%) наблюдается у собак с эозинофильной бронхопневмонией. Также, смешанное воспаление часто встречается при наличии грибковых инфекций [11].
Нейтрофильное воспаление с наличием или без внутриклеточных бактерий может наблюдаться у кошек с пневмонией. Кошки с бронхитом или астмой часто имеют повышенное содержание эозинофилов. Однако нейтрофильное и эозинофильное воспаления не являются патогномоничным для инфекционного или иммунологического процесса, поскольку как эозинофильное, так и нейтрофильное воспаления также можно наблюдать при неоплазии.
Достаточно трудно диагностировать неоплазии из образцов, полученных при БАЛ. Все клетки должны быть исследованы по критериям злокачественности. В небольшом исследовании кошки с гистологически диагностированной карциномой показали нейтрофильное воспаление, но никаких признаков рака не было обнаружено в цитологии жидкости, полученной при БАЛ. Другое исследование показало значительное совпадение количества дифференциальных клеток у кошек с пневмонией, бронхитом и неоплазией. По этим причинам подсчет клеток БАЛ следует интерпретировать в сочетании с клиническими признаками и данными рентгенографии и бронхоскопии.
В норме дыхательные пути не являются стерильными, вследствие чего количественный расчет бактериальных клеток может помочь дифференцировать контаминацию от реальной инфекции дыхательных путей. Содержание более чем 1,7 *103 колониеобразующих единиц на миллилитр характерно для наличия бактериальной бронхопневмонии. Во всех полученных образцах необходимо проводить анализ на наличие аэробов и микоплазм. Анализ на наличие грибков следует проводить в эндемических районах.
Сообщается об использовании ПЦР в диагностике видов Micoplasma, Bordetella bronchiseptica и Toxoplasma gondii. Результаты ПЦР должны быть интерпретированы с осторожностью в связи с тем, что Mycoplasma и Bartonella в норме могут присутствовать в ротоглотке у собак и кошек. Следовательно, положительные результаты не гарантируют того, что данные патогены вызывают текущие клинические признаки у пациента. К тому же отрицательный результат не исключает наличие инфекции. Несмотря на то, что микроорганизм может присутствовать в дыхательных путях, он может быть не представлен в небольшом образце, используемом для экстракции ДНК, в итоге получая ложно-отрицательный результат [5,7,8,9,12].
Таблица 1.
Цитология после проведения БАЛ
.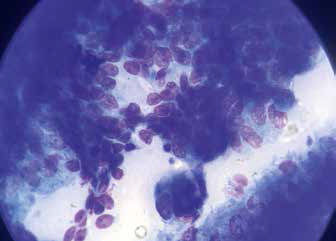

Рис. 7. Сегментоядерные нейтрофилы и альвеолярные Рис. 8. Реснитчатый респираторный эпителий
макрофаги на фоне слизи
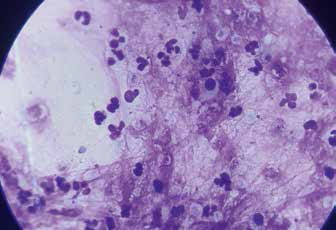
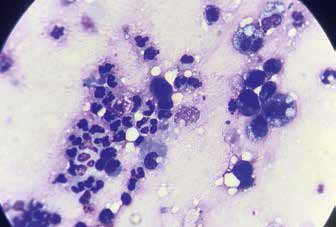
Рис. 9. Сегментоядерные нейтрофилы на фоне Рис. 10. Конгломерат клеток эпителия
эозинофильного
розового межуточного вещества – слизи
Выводы
Диагностическое значение данной процедуры не должно быть переоценено, потому что пациенты с заболеваниями дыхательных путей имеют повышенные риски, связанные с анестезией и респираторными процедурами. Риск проведения процедуры всегда должен быть оценен с точки зрения ожидаемых результатов. Также, как показывают исследования, БАЛ при сопровождении бронхоскопии имеет меньшее количество осложнений и большую диагностическую ценность полученных образцов. Выбор методики также может быть сделан на основании материальной базы ветеринарного учреждения, но в любом случае выполнение БАЛ должно быть регламентировано технически и выполнено подготовленными специалистами.
Литература
1. Carol R. Reinero, DVM, PhD, Diplomate ACVIM (Internal Medicine), University of Missouri–Columbia. Bronchoalveolar Lavage Fluid Collection Using a Blind Technique.
2. Standardization of Bronchoalveolar Lavage Aspiration Techniques to Optimize Diagnostic Yield of Canine Lower Respiratory Tract Samples by Katharine Sarah Woods.
3. Mills PC, Lister AL. Using urea dilution to standardize cellular and non-cellular components of pleural and bronchoalveolar lavage (BAL) fluids in the cat. J. Fel. Med. Surg. 2006; 8:105-110. Mordelet-Dambrine M., Arnoux.
4. Melamies MA, Jarvinen AK, Seppala KM, Rita HJ, Rajamaki MM. Comparison of results for weight-adjusted and fixed-amount bronchoalveolar lavage techniques in healthy Beagles. Am. J. Vet. Res. 72:694–698, 2011.
5. Chalker VJ, Owen WM, Paterson C, et al. Mycoplasmas associated with canine infectious respiratory disease. Microbiology 150:3491–3497, 2004.
6. Creevy KE. Airway evaluation and flexible endoscopic procedures in dogs and cats: laryngoscopy, trans-tracheal wash, tracheobronchoscopy, and bronchoalveolar lavage. Vet Clin North Am Small Anim Pract 2009; 39:869-880
7. Spector D, Wheat J, Beamis D, Rohrbach B, Taboada T, Legendre AM. Antigen testing for the diagnosis of Blastomycosis. J Vet Intern Med 20:711–712, 2006.
8. Egberink H, Addie D, Belak S, et al. Bordetella bronchiseptica infections in cats. J Fel Med Surg 11:610–614, 2009.
9. Anfray P, Bonetti C, Fabbrini F, Magnino S, Mancianti F, Abramo F. Feline cutaneous toxoplasmosis: a case report. Vet Dermat 16:131–136, 2005.
10. American Thoracic Society. Bronchoalveolar lavage guidelines. Jul 8, 2012.
11. Hawkins EC, Berry Cr. Use of a modified stomach tube for bronchoalveolar lavage in dogs. J Am Vet Med Assoc 1999; 215(11):1635-1638.
12. Hawkins EC, Davidson MG, Meuten DJ, et al. Cytologic identification of Toxoplasma gondii in bronchoalveolar lavage fluid of experimentally infected cats. J Am Vet Med Assoc 1997; 210(5):648-650.
13. Hawkins EC, DeNicola DB. Cytologic analysis of tracheal wash specimens and bronchoalveolar lavage fluid in the diagnosis of mycotic infections in dogs. J Am Vet Med Assoc 1990a; 197(1):79-83.
14. Hawkins EC, DeNicola DB, Kuehn NF. Bronchoalveolar lavage in the evaluation of pulmonary disease in the dog and cat: state of the art. J Vet Intern Med 1990b; 4:267-274.
15. Hawkins EC, DeNicola DB, Plier ML. Cytological analysis of bronchoalveolar lavage fluid in the diagnosis of spontaneous respiratory tract disease in dogs: a retrospective study. J Vet Intern Med 1995; 9:386–392.
16. Johnson LR, Drazenovich TL. Flexible bronchoscopy and bronchoalveolar lavage in 68 cats (2001–2006). J Vet Int MEd 2007; 21:219–225.
17. Silverstein DC, Drobratz KJ. Clinical evaluation of the respiratory tract. In: Ettinger SJ, Feldman EC, eds. Textbook of veterinary internal medicine. 7th ed. Saunders Elsevier: St Louis, 2010:1055–1066.
18. Yoneda KY, Morrissey BM. The technique of adult flexible bronchoscopy: part 1. J Respir Dis 2008; 29(11):423-428.
19. Hawkins EC. Bronchoalveolar lavage. In: King LG, ed. Textbook of respiratory disease in dogs and cats. Saunders Elsevier: St Louis, 2004:118-128.
20. Cooper ES, Schober KE, Drost WT. Severe bronchoconstriction after bronchoalveolar lavage in a dog with eosinophilic airway disease. J Am Vet Med Assoc 2005; 227 (8):1257- 1262.
21. Johnson LR, Queen EV, Vernau W, et al. Microbiologic and cytologic assessment of bronchoalveolar lavage fluid from dogs with lower respiratory tract infection: 105 cases (2001-2011). J Vet Intern Med 2013;27(2):259-267.
22. Kirschvink N, Leemans J, Delvaux F, et al. Bronchodilators in bronchoscopy induced airflow limitation in allergen-sensitized cats. J Vet Intern Med 2005;19:161-167.
23. Padrid PA. Laryngoscopy and tracheobronchoscopy of the dog and cat. In: Tams TR, Rawlings CA, eds. Small Animal Endoscopy. St. Louis, MI: Elsevier Mosby, 2011:331- 359.
24. Fluoroscopic-Guided Bronchoalveolar Lavage (F-Bal) for Sampling the Lower Airways of Cats Hooi KS1, Defarges A1 , Nykamp S1, Weese S2, Bienzle D2. Departments of Clinical Studies1 and Pathobiology2, University of Guelph, ON.

Назад в раздел


















