Инфекция borrelia burgdorferi у лошадей (болезнь лайма) / Infection borrelia burgdorferi in horses (lyme disease)

Еще фото
Автор (ы): И. Цачев, П. Маруцов, В. Петров, Кр. Господинова / I. Tsachev, P. Marutsov, V. Petrov, K. Gospodinova
Организация(и): Тракийский университет, Стара Загора, Болгария / Trakia University, Stara Zagora, Bulgarian
Журнал: №5 - 2014
Перевод с болгарского Л.А. Калашникова
УДК 619:636.1:616-022
Ключевые слова: болезнь лайма, спирохеты, иксовидные клещи, заражение
Key words: lyme disease, spirochaetes, ticks, infection
Аннотация
Болезнь Лайма (БЛ) является мультисистемным инфекционным заболеванием у многих видов позвоночных, включая человека и лошадей.
Summary
Lyme disease is a Multisystem infectious disease in many species of vertebrates, including humans and horses.
История и распространение
В последние несколько десятилетий в литературе существует явная тенденция усиления внимания исследователей к БЛ. Начало заболевания связано со второй половиной 70-х гг. XX в. и городом Лайм в штате Коннектикут (США). Steere и его соавторы (1978 г.) описали эпидемию олигоартикулярного артрита у взрослых и детей. Позже Burgdorfer и др. (1982 г.) определили возбудителя заболевания. Отсюда появилось и видовое название инфекционного агента Borrelia burgdorferi. С развитием диагностики заболеваний стало очевидно, что Borrelia burgdorferi не является единственным возбудителем БЛ. Подобные клинические проявления у человека связаны с другими видами боррелии – Borrelia afzelii и B. garinii. Поэтому виды боррелий, этиологически связанные с симптомокомплексом БЛ, известны под собирательным названием Borrelia burgdorferi sensu lato.
У лошадей клинические проявления заболевания являются редкими, имеется относительно небольшое количество научных работ, описывающих отдельные случаи заболевания (Burgess et al., 1986; Burgess and Mattison, 1987; Hahn et al., 1996; Liebisch et al., 1999).
Использование лабораторных диагностических тестов (серологических методов) БЛ показывает, что фактически инвазия спирохетами у лошадей характеризуется значительно более высокой распространенностью (Табл. 1).
Этиология
Бактерии Borrelia – это грамотрицательные спирохеты с длиной 3-30 мкм и поперечным диаметром 0,2-0,5 мкм. Они имеют от 3 до 8 нерегулярных спиральных извивов, с высотой отдельных спиралей 2-4 мкм. Представлены от 7 до 20 аксиально расположенных филаментов. Они могут быть визуализированы с помощью фазово-контрастной микроскопии и темного поля. Боррелии требовательны с точки зрения их культивирования в культуральной среде, растут медленно (7-10 дней) на средах, обогащенных фетальной сывороткой или альбумином, в специфической среде BSK-II (BarbourStoennerKelly II) и др. Типичным для боррелий является то, что это не свободно живущие организмы, и в течение 2-годичного цикла существуют на основе взаимоотношений «паразит-хозяин» (Hinnes, 2006).
Боррелии делятся на две основных филогенетические группы: одна из них является возбудителями болезни Лайма, а вторая объединяет спирохет, связанных с возвратным тифом. На основе генетических анализов в первую группу включены несколько видов спирохет с общим названием B. burgdorferi sensu lato (s.l.) – в широком смысле. Основными видами, имеющими важное медицинское значение для Европы, являются Borrelia garinii и Borrelia afzelii, для Азии – Borrelia afzelii и для Северной Америки – B. burgdorferi sensu stricto – в буквальном (узком) смысле (Normal et al.,1996). Другие виды, имеющие доказательства в основном у людей, – Borrelia valaisiana, Borrelia lusitaniae, Borrelia spielmanii и Borrelia bissettii.
Эпидемиология
В течение жизненного цикла боррелии, этиологически связанные с БЛ, циркулируют среди иксодовых клещей и различных видов позвоночных – грызунов, птиц, диких и домашних животных, в том числе человека, и др. (Ogden et al., 2011). В ветеринарной патологии Borrelia burgdorferi s.l. связана с собаками, кошками, лошадями, овцами, козами и крупным рогатым скотом.
БЛ является заболеванием, типичным для северного полушария с наибольшей частотой встречаемости в умеренных географических широтах. В качестве зооноза она входит в число основных заболеваний, переносимых клещами. Единичные случаи заболевания в необычных для его зоогеографии местах, таких как Австралия и Новая Зеландия, были найдены у людей, которые путешествовали и жили к северу от экватора.
Основной механизм передачи инфекции – через укус инфицированного клеща. Установлены случаи контактного инфицирования человека при попадании спирохет на слизистые оболочки или поврежденную кожу после раздавливания инфицированного клеща.
Главным переносчиком заболевания являются иксодовые клещи, для Европы – это Ixodes ricinus, для Северной Америки – I.scapularis и I.pacificus, для Азии – I.persulcatus. Иксодовые клещи являются триксенными паразитами. При кровососании личинки и нимфы иксодовых клещей заражаются возбудителями от различных типов инфицированных малых позвоночных (обычно грызунов и низко гнездящихся птиц), выступающих в качестве резервуара инфекции в природе. Клещей следует рассматривать скорее как переносчиков болезни, а не в качестве природного резервуара возбудителей. Для них доказана трансфазная, но не трансовариальная передача спирохет. Для других видов клещей также показана возможность инвазии боррелиями при кровососании, но трансовариальная и трансстадийная передача невозможна. Существенной особенностью в отношении хранения возбудителя в иксодовых клещах и, следовательно, в передаче этой болезни является то, что они предпочитают те виды хозяев, от которых были инвазированы при предыдущем хранении возбудителя.
Заражение происходит (как и для других позвоночных) при продолжительном пребывании иксодовых клещей на хозяине. Лошади находятся в большей опасности на тех пастбищах, которые используются для полевых работ, а также для любительской или профессиональной верховой езды. Как правило, высокие серотипы у лошадей связаны с эндемичными районами БЛ, где заболевание часто встречается как у людей, так и у животных. В Соединенных Штатах в 2000 г. Magnarelli с соавторами констатировали у лошадей степень распространенности БЛ более 45% в районе с эндемическим боррелиозом у человека.
Для европейского континента основным резервуаром возбудителя являются мелкие грызуны – польская и обыкновенная лесная мышь (род Apodemus). С эпидемиологической точки зрения, важным резервуаром в природе являются дикие и бродячие животные, особенно птицы. Последние при миграции расширяют нозогеографические характеристики заболевания. Резервуаром для инфекции меньшего порядка являются также сельскохозяйственные животные и домашние любимцы.
Для Соединенных Штатов основным резервуаром инфекции в природе считаются белоногие мыши (Peromyscus leucopus), следом за ними белохвостый олень, североамериканская и красная белка.
Клиника
У лошадей, как и у других видов животных и человека, высокая степень распространенности не совпадает с клиническими проявлениями заболевания. Часто клинические признаки отсутствуют или имеются неясные и непостоянные общие проявления. За постоянные признаки у лошадей принимают скованность движений, хромоту одной или нескольких конечностей, ламинит, артрит (Рис. 1), повышенную чувствительность мышц, вплоть до болезненности, гиперестезию, вялость и изменения в поведении (Browning et al., 1993; DeVilbiss et al., 2009).
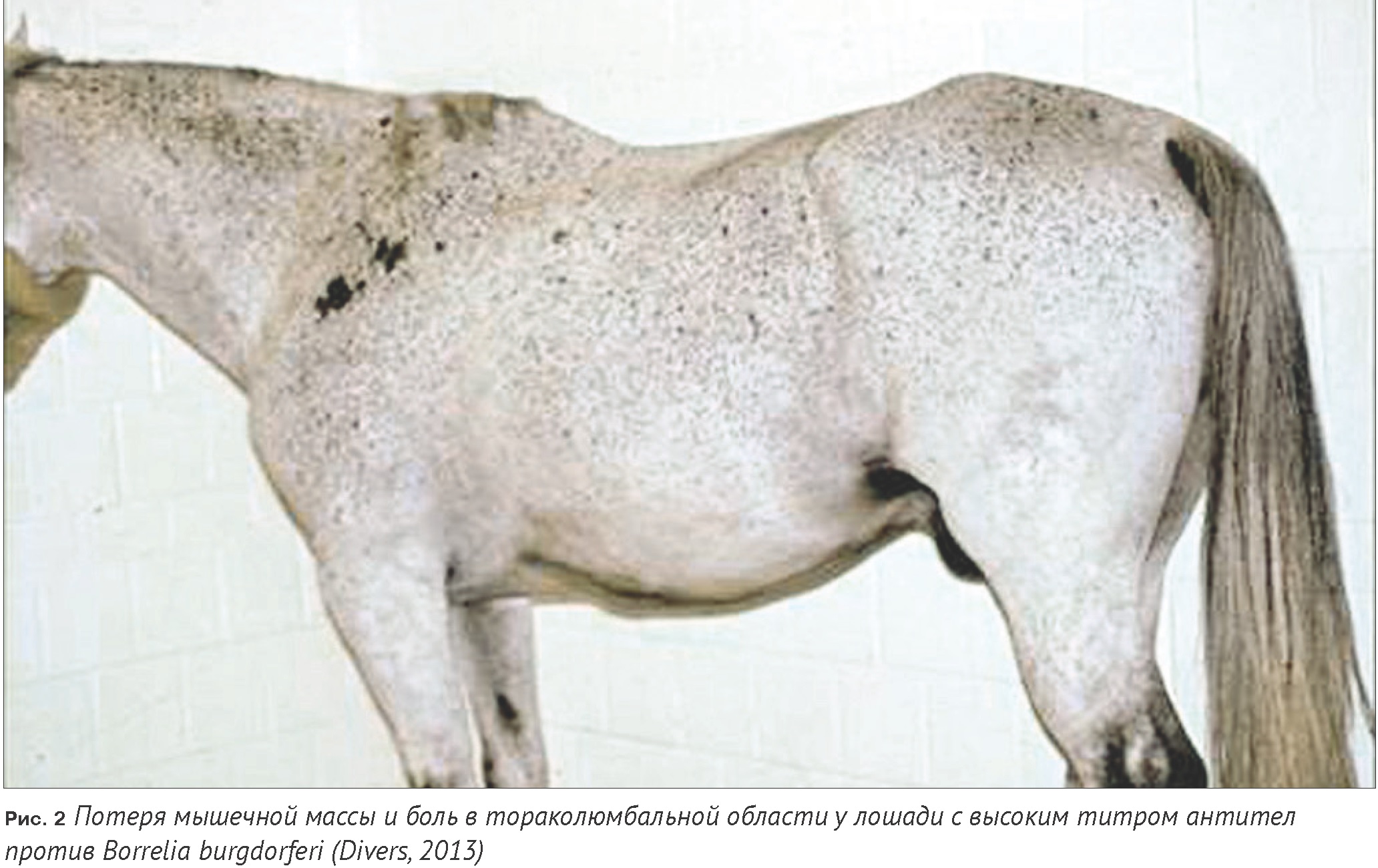
Потеря мышечной массы и боли в тораколюмбальной области встречаются у лошадей с высокими титрами антител (Рис. 2). В некоторых случаях зарегистрированы и неврологические симптомы.
Невроборелиоз Лайма описан у двух лошадей (Imai et al., 2011). У выживших лошадей наблюдается гиперестезия, боли в поясничной области, потеря мышечной массы. На более поздней стадии болезни развивается атаксия, паралич лицевого нерва, депрессия и тремор головы.
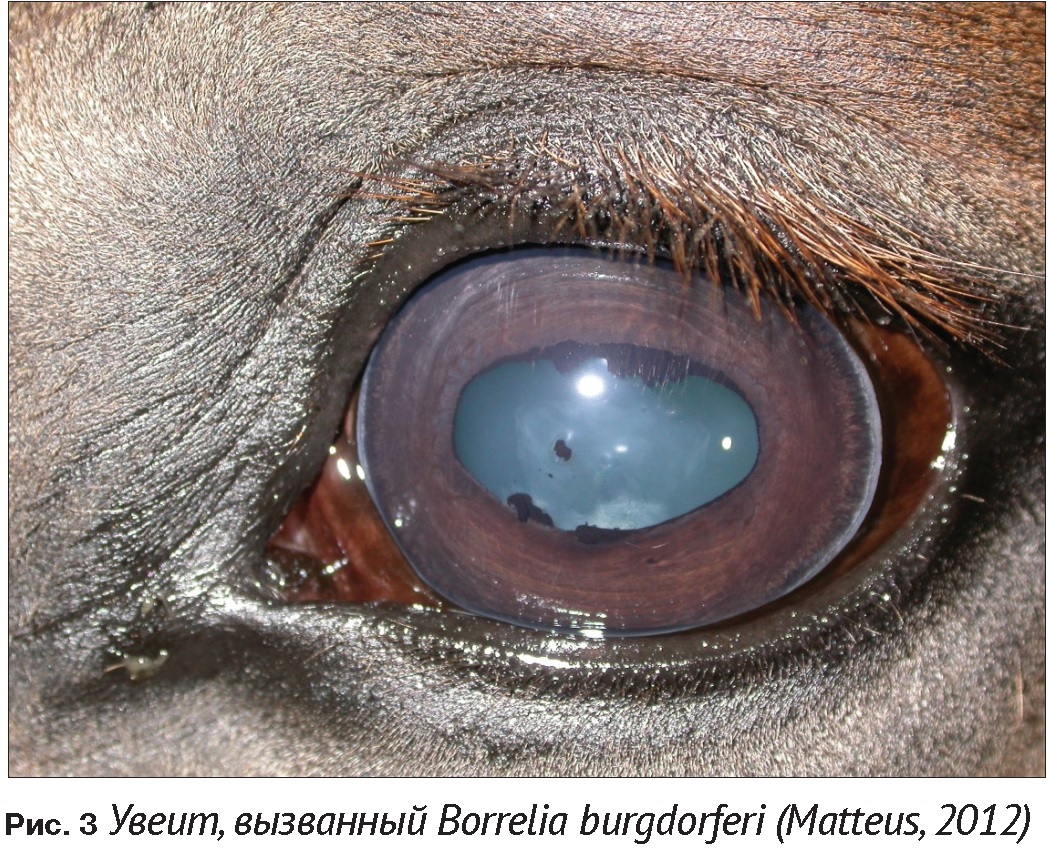
Priest и соавторы (2012) сообщали о двустороннем увеите (Рис. 3), выявленном у двух лошадей. Боррелии обнаружены при цитологическом исследовании и подтверждены ПЦР. У одной лошади увеит сопровождался мультифокальным лимфогистиоцитарным ганглиорадикулитом и невритом.
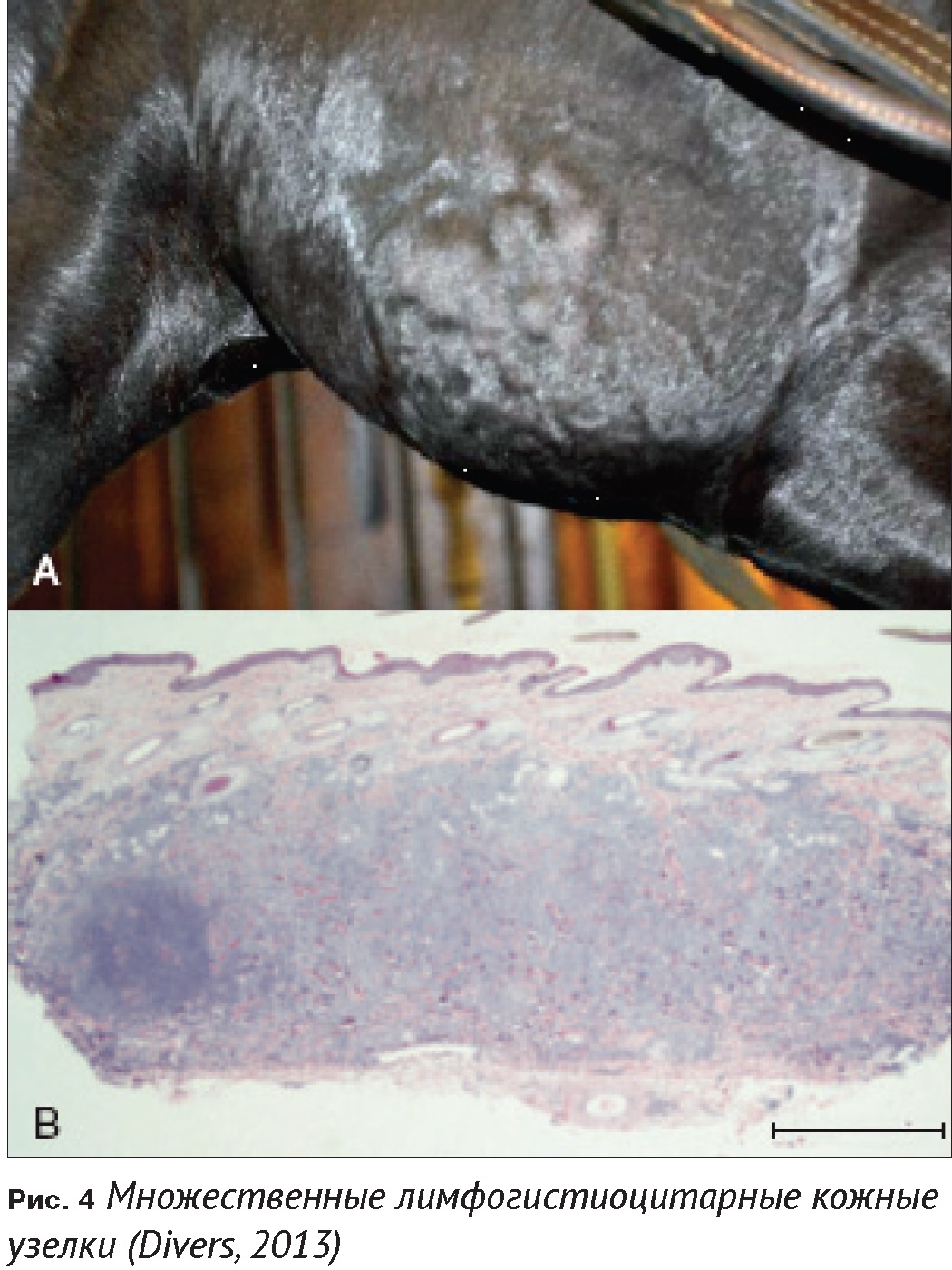
В другом случае описана лошадь с псевдолимфомами (множественными лимфогистиоцитарными кожными узелками) (Sears и др., 2012). У серопозитивных лошадей наблюдались лихорадка и отек конечностей. Возможность их связи с Anaplasma phagocytophilum не может быть отклонена в связи с тем, что многие виды клещей инфицированы двумя возбудителями (Chang и соавт., 2000).
При искусственном заражении B. burgdorferi у пони наблюдались в качестве постоянных признаков кожные поражения и в качестве непостоянных – мышечные, фасциальные, нервные и околосиновиальные изменения (Chang и соавт., 2000).
Патанатомия
При экспериментальных инфекциях наблюдались: лимфогистиоцитарные реакции кожи в месте прикрепления клеща в сочетании с лимфоидной гиперплазией региональных лимфатических узлов (Рис. 4) (Changet al.,1999; Chang et al., 2000; Chang et al., 2005) и
негнойный синовит (Avanzi et al., 1998).
У клинических пациентов отмечали лимфогистиоцитарные воспаления синовиальных мембран, менингит и увеит.
Диагностика
Лабораторная диагностика инфекции наиболее часто основана на серологических методах ИФА и ELISA (Johnson et al., 2008; Hansen et al., 2010; Wagner, 2011; Crisman, 2013; Divers, 2013). Однако интерпретация этих результатов требует контроля во времени, для того чтобы отличить текущую инфекцию от уже перенесенной (Johnson et al., 2008).
Недавно тест ELISA C6 SNAP test (IDEXX Laboratories, Westbrook, ME) был верифицирован и успешно использован в серодиагностике инфекции (Johnson et al., 2008).
Может быть использован Вестерн-блот метод, а также мультиплексный тест antibody bead test для количественного определения антител OSPA, OspC и OSPF (Рис. 5) (Wagner et al., 2011). Известно, что антитела OspC свидетельствуют о текущей инфекции (снижаются в последующие 3-4 месяца), а OSPF указывают на хроническое течение заболевания; высокий процент антител OSPA выявлен у непривитых лошадей.
Также можно использовать ПЦР и патогистологические методы (лимфоплазматическое или гистиоцитарное воспаление).
Терапия
Наиболее часто для лечения лошадей используют следующие антибиотики: тетрациклин (IV), доксициклин (PO), а в последнее время – моноциклина гидрохлорид (PO) (Schnabel, 2012). Доксициклин не может быть использован внутривенно из-за наличия побочных эффектов (Riond et al., 1992), как и тетрациклин, при внутреннем применении вызывающий диарею (White and Prior, 1982). Протокол лечения чаще всего следующий: IV тетрациклин 6,6 мг / кг, каждые 24 ч (или 12 ч) в течение 7-10 дней с последующим PO доксициклина 10 мг / кг, каждые 12 ч, или PO миноциклина 4 мг / кг, каждые 12 ч в течение 1-2 месяцев. При использовании тетрациклина необходим мониторинг почечной функции; у беременных кобыл тетрациклин может привести к аномалиям развития плода.
Хинолоны не подходят для лечения из-за развития резистентности (Schutzer et al., 2011).
Профилактика
Для профилактики заболевания можно успешно применять различные инсектицидные спреи (Frontline; Advantix; Permethrin).
Для иммунопрофилактики применяют вакцины, которые используются для профилактики болезни Лайма у собак. Тем не менее, среди практикующих ветеринарных врачей и владельцев лошадей профилактика заболевания с использованием вакцины остается спорным вопросом.
Здравоохранение
Существует минимальный риск заражения людей от лошадей, пораженных болезнью Лайма.
Болгария
Проведены первые в стране сероэпидемиологические исследования на БЛ у лошадей. 191 лошадь из 10 районов Северной Болгарии была исследована с помощью ЕLISA. В 9 районах инфекция является произвольной, а установленная средняя превалентность равна 20%.
Литература
1. Avanzi S., Messa G., Marbini A. et al: Isolated neuritis of the sciatic nerve in a case of Lyme disease. Ital J Neurol Sci 19(2):81-85, 1998.
2. Bhide M., Yilmaz Z., Golcu E., Torun S., Mikula I. Seroprevalence of anti-Borrelia burgdorferi antibodies in dogs and horses in Turkey, Ann Agric Environ Med, 15, 85-90, 2008.
3. Burgess E.C., Mattison M. Encephalitis associated with Borrelia burgdorferi infection in a horse. J Am Vet Med Assoc; 191:1456-8, 1987.
4. Burgess E.C., Gillette D., Pickett J.P. Arthritis and panuveitis as manifestations of Borrelia burgdorferi infection in a Wisconsin pony. J. Am. Vet. Med. Assoc. 189, 1340-1342, 1986.
5. Burgdorfer W., Barbour A.G., Hayes S.F., Benach J.L., Grunwaldt E., Davis J.P.: Lyme disease – a tick-borne spirochetosis? Science 216, 1317-1319, 1982.
6. Browning A., Carter S.D., Barnes A. et al. Lameness associated with Borrelia burgdorferi infection in the horse. Vet Rec; 132:610-1, 1993.
7. Bryant J.E., Brown M.P., Gronwall R.R. et al: Study of intragastric administration of doxycycline: pharmacokinetics including body fluids, endometrial and minimum inhibitory concentrations. Equine Vet J 32(3):233-238, 2000.
8. Cohen N.D. Borreliosis (Lyme disease) in horses. Equine Veterinary Education; 8:213-215, 1996.
9. Cohen N.D., Heck F.C., Heim B. et al. Seroprevalence of antibodies to Borrelia burgdorferi in a population of horses in central Texas. J. Am. Vet. Med. Assoc, 201:1030-1034, 1992.
10. Chang Y., Novosol V., McDonough S.P: Vaccination against Lyme disease with recombinant Borrelia burgdorferi outer-surface protein A (rOspA) in horses. Vaccine 18(5-6):540-548, 1999.
11. Chang Y.F., Novosol V., McDonough S.P.: Experimental infection of ponies with Borrelia burgdorferi by exposure to Ixodid ticks. Vet Pathol 37(1):68-76, 2000.
12. Chang Y.F., McDonough S.P., Chang C.F. et al. Human granulocytic ehrlichiosis agent infection in a pony vaccinated with a Borrelia burgdorferi recombinant OspA vaccine and challenged by exposure to naturally infected ticks. Clin Diagn Lab Immunol; 7:68-71, 2000.
13. Chang Y.F., Ku Y.W., Change C.F. et al: Antibiotic treatment of experimentally Borrelia burgdorferi-infected ponies. Vet Microbiol 107(3-4):285-294, 2005.
14. Crisman M. Update on Tick-Borne Diseases (Lyme Disease). Proceedings of the 13th International Congress of the World Equine Veterinary Association WEVA, Budapest, Hungary, October 3-5, 2013.
15. Divers T. Lyme Disease; in Equine Infectious Diseases, Edition Sellon D. Long M, 2nd, Elsevier, 311-315, 2013.
16. Divers T. Equine Lyme Disease. Journal of Equine Vet Science, 33: 488-492,2013.
17. Durrani A., Goyal S., Kamal. Retrospective Study on Seroprevalence of Borrelia burgdorferi Antibodies in Horses in Minnesota, Journal of Equine Veterinary Science 31, 427-429, 2011.
18. DeVilbiss B.A., Mohammed H.O., Divers T.J. Perception of equine practitioners regarding the occurrence of selected equine neurologic diseases in the northeast over a 10-year period. J Equine Vet Sci; 29:237-46, 2009.
19. Ebani V.V., Bertelloni F., Pinzauti P., Cerri D. Seroprevalence of Leptospira spp. and Borrelia burgdorferi sensu lato in Italian horses. Ann Agric Environ Med. 19(2):237-40. 2012.
20. Egenvall A., Franzen P., Gunnarsson A., Engvall E.O., Vagsholm I., Wikstrom U.B., Artursson K: Cross-sectional study of the seroprevalence to Borrelia burgdorferi sensu lato and granulocytic Ehrlichia spp. and demographic, clinical and tick-exposure factors in Swedish horses. Prev Vet Med, 49, 191-208, 2001.
21. Fritz C.L., Kjemtrup A.M.: Lyme Borreliosis. J Am Vet Assoc, 223, 1261-1270, 2003.
22. Gliga L., Dumitrache M., SpUnu M. Serological Reactivity to Borrelia burgdorferi Sensu Lato in Dogs and Horses from Distinct Areas in Romania. Vector Borne Zoonotic Dis., 11(9):1259-62, 2011.
23. Hahn C.N., Mayhew I.G., Whitwell K.E. et al. A possible case of Lyme borreliosis in a horse in the UK. Equine Vet J; 28:84-8, 1996.
24. Hansen M., Christoffersen M., Thuesen L. et al. Seroprevalence of Borrelia burgdorferi sensu lato and Anaplasma phagocytophilum in Danish horses. Acta Veterinaria Scandinavica, 52 (3):1-6, 2010.
25. Hinnes M. Equine Infectious Diseases, Debra C. Sellon., Elsevier Science Health Science Division, 310-313, 2006.
26. Johnson A.L., Divers T.J., Chang Y.-F., Validation of an in-clinic enzyme-linked immunosorbent assay kit for diagnosis of Borrelia burgdorferi infection in horses. J. Vet. Diagn. Invest. 20, 321-324, 2008.
27. Imai D.M., Barr B.C., Daft B. et al. Lyme neuroborreliosis in 2 horses. Vet Pathol; 48:1151-7, 2011.
28. Kasbohrer A., Schonberg A. Serologic studies of the occurrence of Borrelia burgdorferi in domestic animals in Berlin (west). Berl Munch Tierarztl Wochenschr, 103:374-8, 1990. [in German].
29. Kiss T., Cadar D., Krupaci A., Bordeanu A., Brudasxca G., Mihalca A., Mircean V. Serological reactivity to Borrelia burgdorferi sensu lato in dogs and horses from distinct areas in Romania. Vector Borne Zoonotic Dis. Sep; 11(9):1259-62, 2011.
30. Liebisch G.; Assmann G.; Liebisch A., 1999: Borrelia burgdorferi and Lyme borreliosis in horses in Germany. Praktische Tierarzt 80(6): 498-516 Ann Agric Environ Med.; 19(2):237-40, 2012.
31. Magnarelli L.A., Ijdo J.W., Van Andel A.E. et al. Serologic confirmation of Ehrlichia equi and Borrelia burgdorferi infections in horses from the northeastern United States. J Am Vet Med Assoc; 217:1045-50, 2000.
32. Normal G.L., Antig J.M., Bigaignon G. et al. Serodiagnosis of Lyme borreliosis by Borrelia burgdorferi sensu stricto, B. garinii, and B. afzelii Western blots (immunoblots). J Clin Microbiol; 34:1732-8, 1996.
33. Ogden N.H., Margos G., Aanensen D.M. et al. Investigation of genotypes of Borrelia burgdorferi in Ixodes scapularis ticks collected during surveillance in Canada. Appl Environ Microbiol; 77:3244-54, 2011.
34. Priest H.L., Irby N.L., Schlafer D.H., Divers T.J., Wagner B., Glaser A.L., Chang Y.F., Smith M.C. Diagnosis of Borrelia-associated uveitis in 2 horses. Vet Ophthalmol; 15(6):398-405, 2012.
35. Riond J.L., Riviere J.E., Duckett W.M. et al: Cardiovascular effects and fatalities associated with intravenous administration of doxycycline to horses and ponies. Equine Vet J 24(1):41-45, 1992.
36. Sears K.P., Divers T.J., Neff R.T. et al. A case of Borrelia-associated cutaneous pseudolymphoma in a horse. Vet Dermatol 23(2):153-6, 2012.
37. Magnarelli L., Fikrig E. Detection of antibodies to Borrelia burgdorferi in naturally infected horses in the USA by enzyme-linked immunosorbent assay using whole-cell and recombinant antigens. Res. Vet. Sci. 79, 99-103, 2005.
38. Maurizi L., Marie J.L., Aoun O., Courtin C., Gorsane S., Chal D. et al. Seroprevalence survey of equine lyme borreliosis in France and Sub-Saharan Africa. Vector
Borne Zoonotic Dis.; 10:535-7, 2010.
39. Matthews L. Lyme Disease in Horses – Eye Problems to Watch out for. Lymediseaseguide.org, 2012 http://lymediseaseguide.org/lyme-disease-in-horses-eye-problems-to-watch-out-for
40. Riond J.L., Riviere J.E., Duckett W.M. et al: Cardiovascular effects and fatalities associated with intravenous administration of doxycycline to horses and ponies. Equine Vet J 24(1):41-45, 1992.
41. Salinas-Melendez J.A., Avalos-Ramirez R., Riojas-Valdez V.M., Martinez-Munoz A.: Serological survey of canine borreliosis. Rev. Latinoam. Microbiol., 41, 1-3, 1999.
42. Schnabel L., Papich M., Divers T., Altier M. et al. Pharmacokinetics and distribution of minocycline in mature horses after oral administration of multiple doses and comparison with minimum inhibitory concentrations. Equine Veterinary Journal, 44(4):453-458, 2012.
43. Schutzer S.E., Fraser-Liggett C.M., Casjens S.R. et al: Whole-genome sequences of 13 isolates of Borrelia burgdorferi. J Bacteriol 193(4):1018-1020, 2011.
44. Steere A.C., Hardin J.A., Malawista S.E. «Lyme arthritis: a new clinical entity». Hosp Pract 13 (4): 143-58, 1978.
45. Stefancikova A., Derdakova M., Skardova I., Szestakova E., Cislakova L., Kovacova D., Stanko M., Petko B: Prevalence of antibodies to Borrelia burgdorferi in horses of east Slovakia. Vet Med Czech 45:227-231, 2000 [in Czech].
46. Stefancikova A, Adaszek L, Petko B, Winiarczyk S, Dudinak V: Serological evidence of Borrelia burgdorferi sensu lato in horses and cattle from Poland and diagnostic problems of Lyme borreliosis. Ann Agric Environ Med 15:37-43, 2008.
47. Veronesi F., Laus F., Passamonti F., Tesei B., Piergili Fioretti D., Genchi C. Occurrence of Borrelia lusitaniae infection in horses, Vet Parasitology, 160, 3-4; 535-538, 2012.
48. Wagner B., Freer H., Rollins S. et al. Development of a multiplex assay for the detection of antibodies to Borrelia burgdorferi in horses and its validation using Bayesian and concential statistical methods. Veterinary Immunology and Immunopathology. 144:374-381, 2011.
49. Wagner B., Freer H., Rollins A. et al: Development of a multiplex assay for the detection of antibodies to Borrelia burgdorferi in horses and its validation using Bayesian and conventional statistical methods. Vet Immunol Immunopathol 144(3-4):374-381, 2011.
50. White G., Prior S.D: Comparative effects of oral administration of trimethoprim/sulphadiazine or oxytetracycline on the faecal flora of horses. Vet Rec 111(14):316-318, 1982.
51. White G., Prior S.D: Comparative effects of oral administration of trimethoprim/sulphadiazine or oxytetracycline on the faecal lora of horses. Vet Rec 111(14):316-318, 1982.


Назад в раздел


















