Наследственные дефекты лошадей: диагностика и профилактика / Inheritable defects of horses: diagnosis and prevention

Еще фото
Автор (ы): Л.А. Храброва, д.с-х.н. / L. Khrabrova
Организация(и): ГНУ ВНИИ коневодства Россельхозакадемии / The All-Russian Research Institute for Horse Breeding
Журнал: №4 - 2014
Ключевые слова: генетическое тестирование, наследственные болезни, лошади
Key words: genetic testing, hereditary diseases, horse
Аннотация
В статье приведен обзор современных научных достижений в изучении наследственных болезней и дефектов лошадей, обусловленных известными генетическими мутациями.
Summary
The article provides an overview of modern scientific achievements in the study of hereditary diseases and defects horses caused by known genetic mutations.
Широко практикуемая в коневодстве система чистопородного разведения, несомненно, способствует не только формированию своеобразного породного аллелофонда каждой популяции, включающего в себя нормально функционирующие генные комплексы, но и накоплению мутантных генов, которые неизбежно возникают в каждом новом поколении. Считается, что одна гамета в среднем несет 4-5 мутаций, большая часть которых не проявляется в фенотипе животного при наличии нормального доминантного аллеля, то есть в гетерозиготном состоянии. В результате применения инбридинга генетический груз пород со временем неизбежно увеличивается и приводит к появлению различных дефектов, что указывает на необходимость тестирования животных на наличие наследственных заболеваний и мониторинга генетической безопасности пород и популяций.
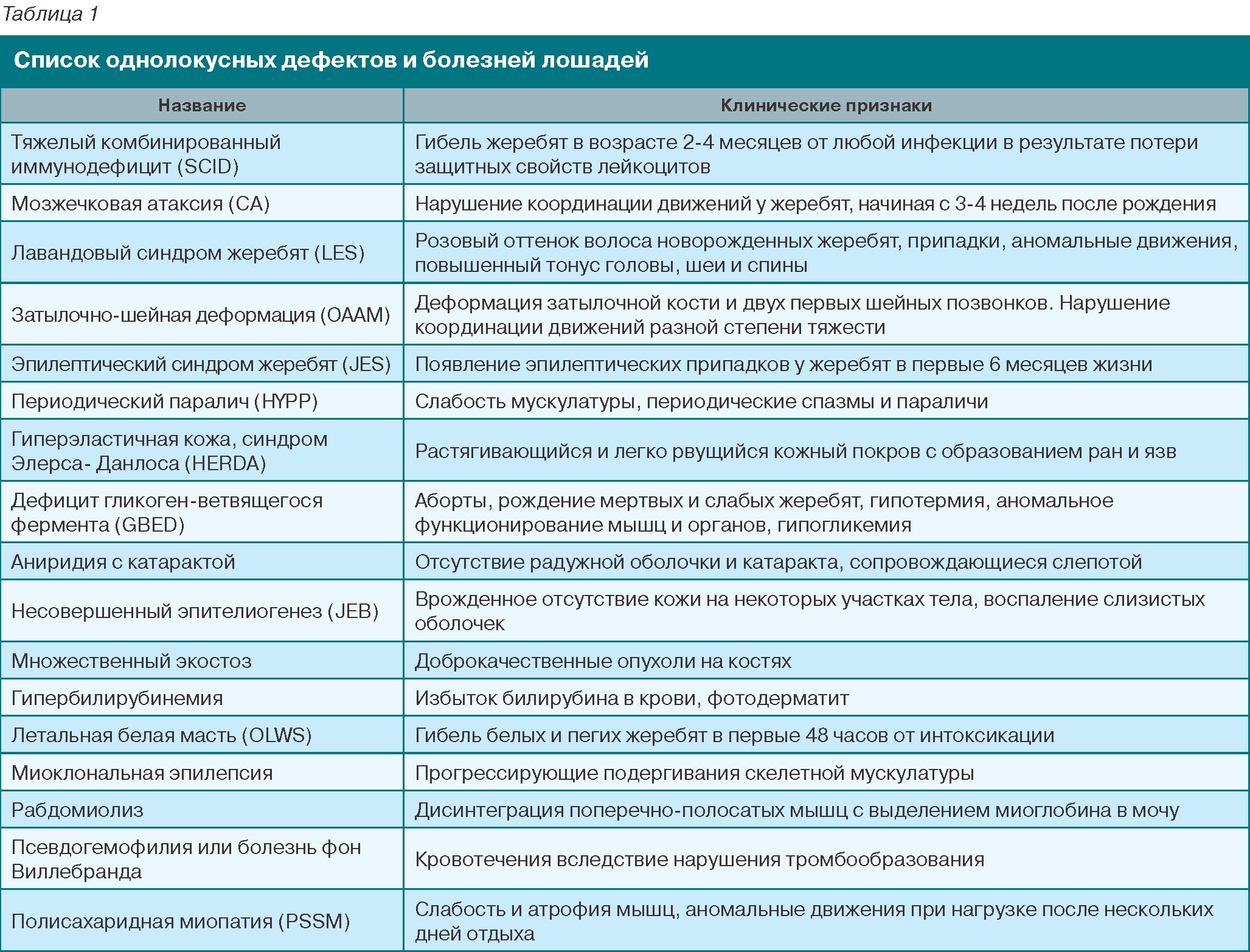
К настоящему времени у лошадей описано более двухсот наследуемых дефектов и заболеваний, многие из которых встречаются у человека и других животных [2, 3, 9]. Благодаря прогрессу в изучении структуры и функции генома лошадей выявлено несколько десятков однолокусных мутаций, детерминирующих наследственные дефекты и заболевания эквидов. В последние годы разработаны методы ДНК-диагностики ряда наследственных дефектов лошадей, и многие генетические лаборатории уже предлагают свои услуги по тестированию дефектных аллелей. Аналитическая информация по однолокусным дефектам лошадей представлена на сайте http:// www.omia.angis.org.au.
Участившиеся случаи регистрации наследственных заболеваний у нескольких пород лошадей свидетельствуют о необходимости повышения информированности селекционеров по вопросам диагностики и профилактики генетических дефектов. Очевидно, что при использовании производителей с дефектными генами генетический груз популяции будет быстро увеличиваться. Эффект дефектных генов может проявиться только через несколько поколений, чему способствует систематическое использование инбридинга. В результате взаимодействия генов степень действия мутантного аллеля может заметно варьировать, что проявляется в разной степени выраженности симптомов заболевания. Условия окружающей среды также могут усилить или ослабить проявление болезни, если она не носит летального характера.
Первыми у жеребят были описаны несовместимые с жизнью анатомические пороки, такие как атрезия (непроходимость) прямой кишки, абрахия (отсутствие грудных конечностей), неправильное формирование локтевой и большой берцовой костей и искривление шеи. Родители жеребят с перечисленными дефектами имели нормальный фенотип, что указывает на рецессивный тип наследования таких аномалий.
У лошадей зарегистрировано несколько наследственных дефектов зрения, включая отсутствие глазного яблока (анофтальм) и радужной оболочки (аниридия), помутнение роговицы и другие заболевания, которые приводят к ухудшению и даже полной потере зрения.
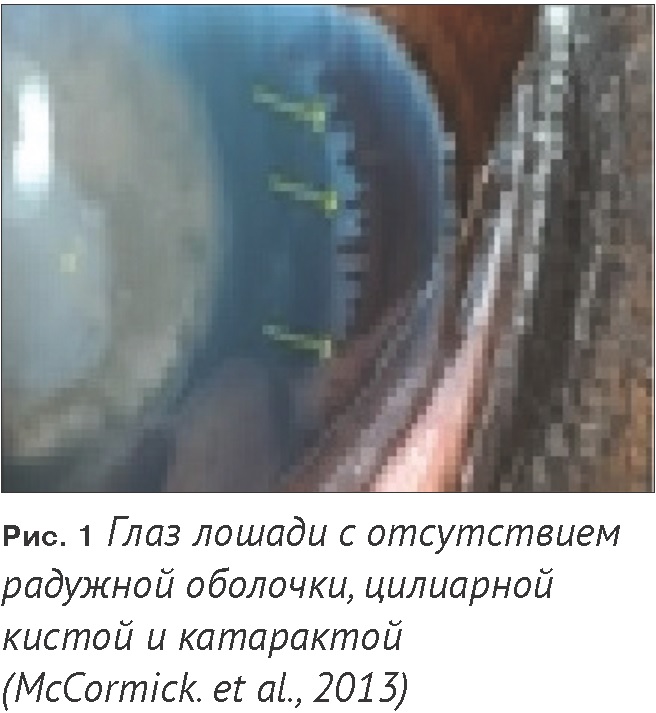
Аниридия – это достаточно редкое врожденное заболевание лошадей, которое проявляется светобоязнью, сильным снижением остроты зрения, катарактой, глаукомой и другими проблемами глаз. Помимо этого отсутствию радужной оболочки сопутствуют патологические изменения других органов и систем организма – нервной, мочеполовой, эндокринной, пищеварительной. Эта аномалия была описана у лошадей самых разных пород. В изученных популяциях лошадей были отмечены разные механизмы наследования этого дефекта, что указывает на его сложную генетическую природу.
Оказалось, что у лошадей имеется синдром множественных врожденных аномалий глаз (Equine Multiple Ocular Anomalies, MCOA) – это набор аномалий, локализованных на передней части глаза и в целом типичных для аниридии [4]. Заболевание проявляется в разных формах, имеет кодоминантный тип наследования и контролируется генами, локализованными в 6-й хромосоме. У животных, являющихся гетерозиготными носителями мутантного аллеля, наблюдали кисты, образованные из временного цилиарного тела, периферической сетчатки или радужки. Лошади, гомозиготные по дефектному аллелю, имели набор множественных аномалий, включая кисты, гипоплазию радужки и врожденную катаракту (Рис. 1). Молекулярно-генетический анализ показал, что синдром множественных врожденных аномалий глаз у лошадей обусловлен несколькими генами, тесно связанными с локусом MCOA.
Вредные мутации могут накапливаться в аллелофонде отдельных пород, при этом частота их проявления будет зависеть от ряда факторов, включая степень распространения мутантного аллеля, селекционной ценности его носителей (жеребцов и маток), численности животных данной породы или популяции и системы разведения. Среди лошадей фризской породы уже многие годы изредка (с частотой 0,25%) появляются низкорослые особи с укороченными конечностями и недоразвитыми ребрами. Проведенное учеными полногеномное сканирование показало, что в появлении данного дефекта развития виновен мутантный ген Dwarfism, который локализован в 14-й хромосоме [16].
Генетическую природу имеет и такой дефект лошадей, как дегенеративные изменения поддерживающих связок – Degenerative suspensory ligament desmitis (DSLD). Клинические признаки этого синдрома – потеря эластичности, утолщение или дегенерация связок конечностей, нарушение восстановительной функции коллагеновых волокон.
Наследование и механизм развития заболевания не установлен, известно только, что оно передается внутри семейных линий. Лечение и предупреждение заболевания основаны исключительно на практическом опыте и на данный момент пока еще недостаточно эффективны. Исследования свидетельствуют, что это заболевание у разных пород лошадей протекает по-разному. Болезнь начинается как ослабление сухожилий пальцевого сгибателя и приводит к неизлечимой деформации конечности и хромате. Могут быть затронуты только 2 или все 4 конечности (Рис. 2).
Недавно проведенные исследования показали, что причиной провислой спины у лошадей может быть миссенс-мутация. Мягкая спина может проявляться как врожденный или приобретенный возрастной признак. Полногеномный ассоциативный анализ молодых лошадей американской верховой породы с провисшей спиной выявил, что у 17 из 20 отобранных животных этот дефект был обусловлен нуклеотидной заменой в структуре гена, локализованного в 20-й хромосоме. Все 17 лошадей имели гомозиготные варианты дефектного гена, что указывает на рецессивный характер проявления этого нежелательного признака.
Остеохондроз относится к наследственным ортопедическим нарушениям, часто выявляемым радиографически у молодых лошадей. Передача остеохондроза по наследству отмечена у нескольких пород лошадей, при этом коэффициент наследуемости h2 варьировал от 0,10 до 0,37. Причиной возникновения остеохондроза у лошадей являются очаговые нарушения дифференциации и созревания хондроцитов в течение внутрихондрального окостенения и наиболее часто наблюдается в путовом, скакательном и коленном суставах. Клинические проявления остеохондроза могут привести к преждевременной выбраковке животного в результате хронической хромоты.
Методом семейного геномного анализа у лошадей ганноверской породы были определены гены-кандидаты, связанные с возникновением остеохондроза, и установлено, что они локализованы на 2-й хромосоме. Наиболее частой мутацией на изученном участке этой хромосомы оказалась трансверсия С>Т. Была установлена статистически значимая связь остеохондроза с генами NCDN, FCN3 и MECR. Один из них, нейрохондрин (NCDN), является регулятором роста хондроцитов и хрящевой ткани.
Генетические дефекты арабских чистокровных лошадей
Всемирная Ассоциация арабских лошадей (WAHO) первой обратила внимание на проблему врожденных заболеваний и приняла решение о необходимости проводить генетическое тестирование регистрируемых лошадей на наличие трех наследственных заболеваний, включая: тяжелый комбинированный иммунодефицит (SCID), мозжечковую атаксию (СА) и лавандовый синдром жеребят (LES), которые являются причиной гибели молодняка в первый год жизни. С целью контроля распространения этих летальных мутаций в породе, WAHO рекомендует регистрам ставить в паспортах отметку о результатах генотипирования арабских лошадей по проблемным локусам, но предупреждает о недопустимости какой-либо дискредитации носителей мутаций и их владельцев.
Тяжелый комбинированный иммунодефицит (Severe Combined Immunodeficiency Disorder, SCID) – это рецессивное заболевание иммунной системы, которое встречается у 0,4-8% арабских жеребят, а также у лошадей с примесью арабской крови. Данное заболевание было открыто и описано McGuire и Poppie в 1973 году, но его природа была раскрыта не сразу. Жеребята, унаследовавшие мутантные гены от родителей, рождаются внешне здоровыми, но после 2-х месяцев, когда заканчивается колостральный иммунитет, заболевают и погибают от любой инфекции. В итоге многолетних исследований был открыт молекулярный механизм SCID и установлено, что это заболевание вызывается утратой 5-ти пар нуклеотидов в гене ДНК-протеинкиназы [20]. Выявленная делеция приводит к синтезу фермента с полным отсутствием специфической активности (нулевой аллель) и, как следствие, нарушению защитной функции лейкоцитов. Данная мутация была выявлена и в отечественной популяции арабских лошадей [1] и встречалась с частотой 1,92%.
Мозжечковая атаксия (Cerebellar Abiotrophy, СА) жеребят была отмечена у лошадей арабской, готлендской и ольденбургской пород, миниатюрного пони, а также представителей диких видов эквидов в зоопарках. При этом заболевании у внешне здоровых жеребят отмечают нарушения в координации движения, спотыкающуюся походку, внезапные опрокидывания на спину. Первые клинические признаки заболевания проявляются на 3-4 неделе жизни и становятся все более тяжелыми из-за постепенного развития полного паралича жеребят. Аналогичное нейрологическое заболевание было описано у кошек, собак, свиней, овец и крупного рогатого скота.
Мозжечковая атаксия лошадей наследуется по рецессивному типу и является формой церебральной гипоплазии, которая обусловлена дегенеративными изменениями в клетках Пуркинье, происходящими после рождения внешне здорового жеребенка и в итоге приводящими к его гибели [5]. Следует отметить, что нарушения двигательной функции (атаксия) проявляются и у жеребят с затылочно-атлантно-осевым пороком (ОААМ). Как правило, пораженные этим дефектом жеребята не в состоянии подняться и передвигаться. В некоторых случаях симптомы атаксии наблюдаются при таких заболеваниях, как эпилептический синдром жеребят (JES), синдром Воблера (Wobbler syndrom) или протозойный миелоэнцефалит. Поэтому необходима дифференциальная лабораторная диагностика СА, которая была недавно разработана (www. vhlgenetics.com) и с 2012 года стала доступной для владельцев и ветеринарных специалистов.
Лавандовый синдром жеребят (Lavender Foal Syndrome, LES), также известный как летальный дефект осветления масти (Coat Color Dilutional Lethal), был зарегистрирован у новорожденных арабских жеребят египетского происхождения. Этот синдром получил свое название по фенотипическому проявлению – аномальному оттенку масти родившихся жеребят – серебристо-розовому, лавандовому, осветленному рыжему или розово-серому. Помимо этого у жеребят наблюдались такие симптомы, как припадки, непроизвольные движения глазных яблок, ригидность конечностей, аномальные движения и повышенный тонус мышц головы, шеи и спины.
Команда специалистов из Корнельского (Cornell) университета и Максвелловского научного центра коневодства установила, что LES вызывается рецессивной мутацией гена миозин Va (MYO5A), произошедшей в регионе 30-го экзона [7]. Транспортный комплекс MYO5A отвечает за попадание пигмента в кератиноциты и транспорт передающей субстанции в нервных клетках. Мутация нарушает нормальную функцию меланоцитов, определяющих окраску волос лошади, и нервных клеток. Частота встречаемости гетерозиготных носителей данной мутации среди арабских лошадей египетской популяции составила 10,3%, но в нашей стране жеребят с лавандовым синдромом пока не зарегистрировано.
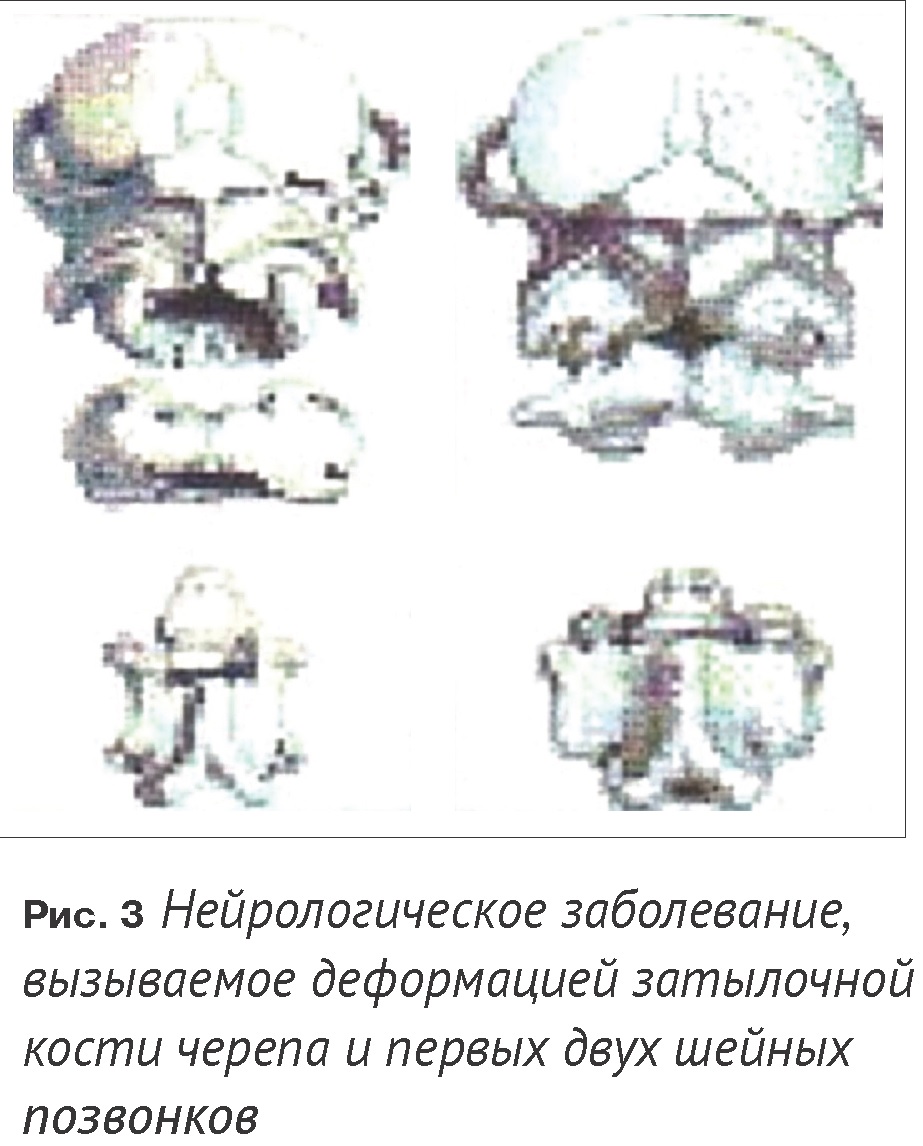
Еще одним серьезным генетическим дефектом арабских лошадей является затылочная атланто-аксисная деформация (Occipital Atlanto-Axial Malformation, ОААМ). Это нейрологическое заболевание, вызываемое деформацией затылочной кости черепа и первых двух шейных позвонков (Рис.3). Такая аномальная конструкция вызывает сдавливание нервного волокна, что ведет к различным нарушениям.
Клинические признаки данного порока ранжируются от средней дискоординации движений и слабости до неспособности вставать и могут проявляться как у новорожденных жеребят, так и спустя несколько недель после рождения. Жеребята с таким дефектом обычно подлежат эвтаназии. Предполагается аутосомный рецессивный тип наследования данного дефекта, генетическая диагностика заболевания пока еще не разработана.
Эпилептический синдром жеребят (Juvenile Epilepsy Syndrome, JES) или идиопати-ческая эпилепсия (IE) – это заболевание мозга, проявления которого регулируются самим организмом и обычно не фатальны. Жеребята рождаются вполне нормальными, но начинают демонстрировать припадки в первые 6 месяцев жизни. В возрасте 1-2 лет эпилептические приступы прекращаются. Больные жеребята могут иметь проблемы с сосанием, поэтому подвержены заболеванию пневмонией. Необходимо следить, чтобы они не сосали и не ели до окончания активной фазы приступа. Предполагается доминантный тип наследования этого заболевания, наличие которого рекомендуется регистрировать и учитывать при разведении арабских лошадей.
Наследственные нарушения обмена веществ
Периодический паралич лошадей (Hyperkaliemic periodic paralysis, HYPP) – это аутосомное доминантное заболевание, которое описано у лошадей многих верховых пород. Этот генетический дефект вызван мутацией гена, которая привела к нарушению механизма проницаемости натриевого канала скелетных мышц и опасному дисбалансу концентрации натрия и калия. Гиперкалиемия (повышение концентрации калия) в плазме крови проявляется периодическими спазмами и слабостью мускулатуры, вплоть до паралича. Благодаря доминантному характеру наследования, HYPP обязательно проявляется у гетерозиготных носителей, что значительно упрощает контроль над распространением этой мутации в породах лошадей. Разработан метод лабораторной диагностики мутации HYPP (Рис.4).
Врожденный буллезный эпидемолиз (Junctional epidermolysis bullosa, JEB) – аутосомное рецессивное заболевание. Оно проявляется в виде воспаления и пузырьковой сыпи на слизистых оболочках ротовой полости, врожденного отсутствия кожи на некоторых участках тела, чаще всего на голове, шее, туловище и конечностях ниже запястного и скакательного суставов, поэтому ее основа приобретает окраску от перламутровой до кроваво-красной. Также наблюдается ломкость копытного рога. Жеребята обычно рождаются живыми, но с эрозией на коже, возникающей в местах травм, и погибают в течение нескольких недель после рождения. Это неизлечимое наследственное заболевание встречается у бельгийских и американских тяжеловозов и американских верховых лошадей.
Установлено, что причиной буллезного эпидемолиза являются мутации в генах LAMB3, LAMC2 и COL17A1, которые ответственны за взаимодействие белков кожи. В результате кожа становится очень хрупкой и повреждается даже при незначительных травмах. Разработан генетический тест диагностики LАМВ3-мутации, вызывающей данное заболевание [10].
Еще одним тяжелым дефектом лошадей с доминантным типом наследования является миопатия полисахаридного накапливания (Polysaccharide Storage Myoparty, PSSM). Это нервно-мышечное заболевание, диагностированное у представителей ряда тяжелоупряжных и верховых пород, включая чистокровных верховых и арабских лошадей. Клинические признаки этого заболевания проявляются уже после небольшой нагрузки отдыхавших несколько дней лошадей в виде мышечной боли, закрепощенности, потливости, слабости и нежелания двигаться, с более частым поражением задних конечностей. Похоже, что именно это заболевание ранее описывали как «праздничную болезнь лошадей».
Как было недавно установлено, причиной PSSM является мутация в гене гликоген синтетазы 1 (GYS 1), регулирующем синтез гликогена [18]. Мутация этого фермента приводит к нарушению синтеза гликогена и потенциально замедленному метаболизму гликогена. Важно учитывать, что клинические признаки этого заболевания могут проявляться у лошадей в разном возрасте. У молодых жеребят может наблюдаться слабость и скованность движений. Для постановки окончательного диагноза у лошадей старше 2 лет применяют биопсию с последующим гистохимическим окрашиванием тканей. Специалисты рекомендуют проводить генетическое тестирование мутации GYS 1, которое можно делать в любом возрасте.
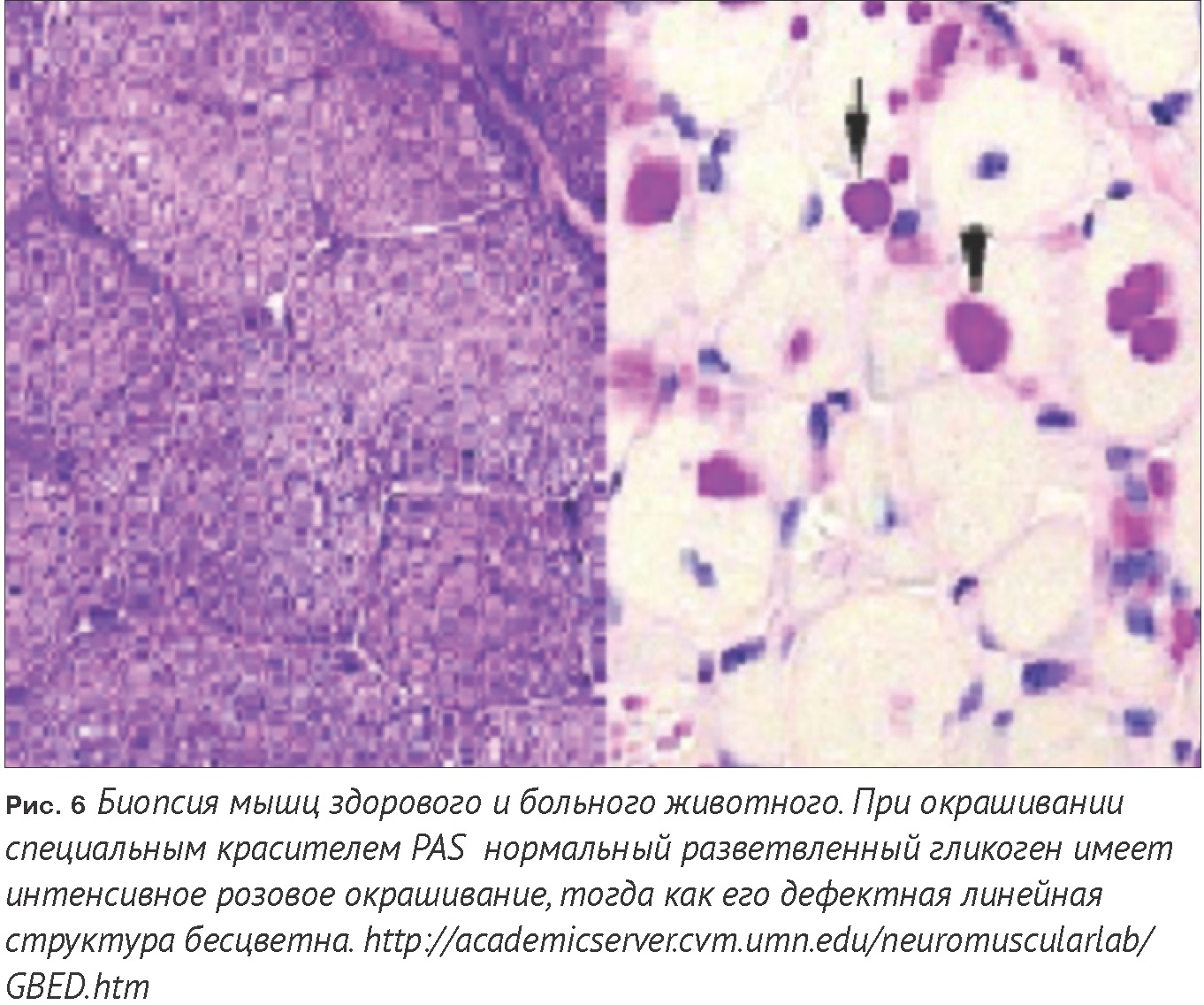
Дефицит гликоген-ветвящегося фермента (Glycogen Branching Enzyme Deficiency, GBED) – аутосомальное наследственное заболевание с рецессивным типом наследования. Данная патология описана у четвертьмильных и пинто лошадей с частотой встречаемости 7,1-8,3%. Больные жеребята рождаются мертвыми или погибают через пару месяцев после рождения вследствие анормальной работы жизненно важных органов, таких как сердце, мозг и скелетная мускулатура. Клинические признаки дефицита фермента GBE 1: кратковременный сгибательный дефект конечностей, симптомы легочной и сердечной недостаточности, возобновляющиеся в состоянии покоя животного, в некоторых случаях скачкообразная гипоглицемия. В крови больных животных наблюдается лейкоцитопения (уменьшение количества лейкоцитов), понижение концентрации глюкозы на фоне повышения мышечного фермента креатининкиназы, аспартатаминотрансферазы и фермента печени гамма глутамилтраансферазы. Причина заболевания была обнаружена при биопсии мышц здоровых и больных животных (Рис.6). Оказалось, что клетки больных лошадей не способны накапливать гликоген правильной конфигурации, т.е. в клетках отсутствует (1,4-а-) гликоген ветвящийся фермент или амило-1,4-1,6-трансгликозидаза. Это фермент класса трансфераз, катализирующий образование новых точек ветвления в молекуле гликогена. Отсутствие данного фермента приводит к синтезу линейной молекулы гликогена, которую клетка не способна использовать в качестве источника глюкозы. Было доказано, что выделение фермента кодируется GBE 1 геном, находящимся на 26-й хромосоме. Разработан генетический тест для диагностики GBED [9].
Гиперэластичная кожа (Equine Hyperelastosis Cutis) – аутосомное рецессивное заболевание. Также известно под названиями синдром Элерса-Данлоса или наследственная кожно-зональная астения лошадей (HERDA).
Подобное заболевание описано у человека, собак, овец, кошек и кроликов. Частота появления этого синдрома у четвертьмильных лошадей в среднем составляет 3,5% [20].
Обычно клинические признаки заболевания у лошадей проявляются в возрасте полутора лет и старше и часто ассоциируются с заездкой или травмами. Лошади с гиперэластичной кожей предрасположены к образованию серозных опухолей и гематом, имеют растягивающийся и легко рвущийся кожный покров с образованием ран и язв (Рис.7).
Биопсия показала, что кожа таких лошадей имеет нормальную толщину, но в ней наблюдается вариабельность диаметра коллагеновых волокон, а также отсутствует их правильная упаковка. Генетический дефект гиперэластичной кожи у лошадей инициируется заменой всего одного основания G>A в 115 кодоне циклофилина В (cyclophilin B, PPIB). Этот ген, вероятно, играет роль в белковой компоновке коллагена. Для диагностики HERDA применяют гистологическое исследование биопсийных проб кожи, а генетический тест на наличие мутации проводят в Калифорнийском университете Дэвиса и Коннельском университете.
Хроническая прогрессирующая лимфодема (Chronic Progressive Lymphedema, CPL). У лошадей крупных тяжелоупряжных пород (шайров, клайдесдалей, бельгийских тяжеловозов) встречается тяжелое нарушение двигательной функции конечностей, которое ведет к преждевременной смерти животных. Нормальное функционирование лимфатических сосудов зависит от наличия действующих волокон эластина. У лошадей с хронической прогрессирующей лимфодемой наблюдались первоначально более низкий уровень эластина в коже и накопление эластина по мере прогрессирования болезни. Предполагают, что причиной этого заболевания является нарушение поддерживающей функции эластичных волокон кожи и лимфатических сосудов. Клиническими признаками лимфодемы в основном являются деформации кожи на нижних отделах конечностей (мокрецы). Генетическая составляющая этого заболевания не вызывает сомнений. Полногеномное сканирование показало, что это заболевание связано с генами, локализованными на хромосомах б 9, 16 и 17, при этом для разных пород лошадей характерны свои ассоциации.
Наследственные заболевания, сцепленные с половыми хромосомами
Поведение генов, расположенных в половых хромосомах, строго соответствует наследованию самих хромосом. Если мутантный ген находится в одной из Х-хро-мосом матери, то эту хромосому независимо от пола получат 50% ее детей. Если ген наследуется рецессивно, то все сыновья с дефектным материнским аллелем окажутся больными. Тогда как дочери, имея хотя бы один нормальный отцовский ген, будут фенотипически здоровы (но будут передавать этот мутантный ген своему потомству по такой же схеме). При Y-сцепленном заболевании больны также будут только мужские особи, и, в отличие от Х-сцепленных аномалий, жеребец-носитель будет передавать заболевание только своим сыновьям, а его дочери и их потомство будут здоровы и свободны от генетического груза.
Дефицит глюкозо-6-фосфат дегдрогеназы (Equine glucose-6-phosphate dehydrogenase deficiency, G6PD). Дефицит Г6ФД относится к достаточно распространенным Х-сцепленным дефектам человека, который встречается преимущественно у мужчин и характеризуется аномально низким уровнем этого фермента. Г6ФД играет важную роль в метаболизме клеток красной крови, поэтому заметное снижение активности фермента приводит к разным формам гемолитических анемий и другим системным патологиям. Аналогичное заболевание описано у многих видов домашних животных, включая лошадей. Симптомы дефицита Г6ФД могут появляться под воздействием стресса, инфекций, «оксидативных» лекарств и при употреблении бобовых культур.
У лошадей генетика дефицита Г6ФД пока еще изучена недостаточно, хотя очевидно, что его симптоматика будет проявляться преимущественно у жеребцов и распространяться через их дочерей – носителей дефектных генов. Заболевание наследуется как связанный с полом рецессивный признак и обуславливает ослабленное здоровье и невысокую работоспособность лошадей. При данном заболевании наблюдаются определенные аномалии в эритроцитах лошадей, указывающие на регенеративные и окислительные нарушения, включая эксцентроцитоз, пикноцитоз, анизоцитоз, макроцитоз и увеличение числа телец Хауэлла-Жолли по сравнению с нормальными лошадьми.
Гемофилия А или дефицит фактора VIII – это общее заболевание для многих видов млекопитающих, которое носит хронический характер и обусловлено дефицитом антигемофильного глобулина, одного из плазменных факторов свертывания крови. Гемофилия А наследуется по рецессивному Х-сцепленному типу, характеризуется замедленной свертываемостью крови и, как следствие, повышенной кровоточивостью гематомного типа при уколах, порезах и других травмах. Кровотечения локализуются не только в месте повреждений, но и на внутренних органах и могут возникать спонтанно. Типичный симптом гемофилии – кровоизлияния в суставы (гемартрозы), очень болезненные и нередко сопровождающиеся высокой лихорадкой. Чаще страдают коленные, локтевые, голеностопные суставы, реже – плечевые, тазобедренные и мелкие суставы конечностей.
Это заболевание чаще всего регистрируется у лошадей арабской, стандартбредной и чистокровной верховой пород. Кобылы являются асимптоматическими носителями дефектного гена, на что может указывать появление в приплоде жеребчиков с плохой свертываемостью крови. Частота встречаемости этого заболевания в популяциях и породах может увеличиваться при применении близкого инбридинга. Следует учитывать, что симптомы проявления гемофилии А могут заметно варьировать в зависимости от снижения активности фактора VIII. У новорожденного жеребенка заболевание проявляется в форме геморрагий по всему телу и кровотечений из пуповины. В норме у лошадей при небольших кровотечениях кровь должна свертываться в течение 10-20 мин.
Причиной кровоточивости при гемофилии является нарушение первой фазы свертывания крови – образования тромбопластина в связи с наследственным дефицитом антигемофильных факторов. Тяжесть геморрагических проявлений при гемофилии связана с концентрацией антигемофильных факторов. Для этого заболевания характерным является нормальное количество тромбоцитов и нормальное содержание фактора Виллебранда. Это позволяет дифференцировать гемофилию с болезнью фон Виллебранда, при которой наблюдаются эпизодические спонтанные кровотечения.
Псевдогемофилия или болезнь фон Виллебранда наследуется по типу аутосомного доминирования и вызывается дефицитом плазменного белка vWF (фактора Виллебранда), который играет жизненно важную роль в адгезии тромбоцитов и защищает VIII фактор от протеолиза. Это заболевание может быть причиной носовых кровотечений у лошадей чистокровной верховой и других пород [6,17].
Половая трансформация мужской-женский тип у лошадей происходит в результате нарушения механизмов развития, при которых фенотипические особи женского пола обычно имеют кариотип 64, XY. Исследования на молекулярном уровне помогли раскрыть причину появления половой трансформации XY кобыл, известной также как гонадальный дисгенез. Это нарушение характеризуется наличием мужского генотипа XY в каждой клетке организма кобылы при наличии нормально выраженных вторичных женских признаков. Большинство «феминизированных» животных имеет нормально развитые гениталии и не проявляет каких-либо аномалий поведения. Очевидной причиной бесплодия таких кобыл является дисгенез яичников и недоразвитая матка. По фенотипическим признакам такие лошади очень сильно напоминают 64, ХО кобыл.
Как показали исследования, данный синдром вызван потерей локализованного на Х-хромосоме SRY гена, определяющего дифференциацию гонад эмбриона по мужскому пути [18]. Делеция гена приводит к трансформации генотипа жеребца в фенотип кобылы. Считается, что SRY пептид является первым сигналом, который запускает развитие недифференцированных гонад плода по мужскому пути. При отсутствии этого «спускового курка» эмбриональные гонады развиваются по женскому пути, формируя вторичные женские половые признаки.
Дефицит функции андрогенного рецептора, локализованного на Х-хромосоме, приводит к тестикулярной феминизации или синдрому андрогенной невосприимчивости (Androgen insensitivity syndrome, AIS), наследуемому как рецессивный признак [11]. При этом синдроме особи с женскими вторичными половыми признаками (включая наружные органы) и XY хромосомной конституцией бесплодны, имеют неопущенные семенники и недоразвитые семявыводящие каналы. Данная аномалия была зарегистрирована преимущественно у лошадей верховых пород. У всех на сегодняшний день изученных видов наследуемость Х-сцепленных аномалий имеет рецессивный характер. На примере человека и лабораторных животных было установлено, что причиной появления такой аномалии является дефицит андрогенового рецептора DHTR [13]. Возникновение такой аномалии у лошадей американской верховой породы было обусловлено заменой одного нуклеотида в старт-кодоне андрогенового рецептора [19]. Наличие Y-хромосомы заставляет недифференцированные эмбриональные железы развиваться в семенники, но при отсутствии андрогенного рецептора вырабатываемые андрогены не могут оказывать должного эффекта. В результате эмбрион развивается по женскому типу и имеет недоразвитые мужские гениталии.
В настоящее время молекулярные методы диагностики наследственных заболеваний лошадей, ассоциированных с половыми хромосомами, пока еще не разработаны. Тем не менее, при подозрении на половую трансформацию рекомендуется использовать цитогенетические методы. Селекционерам нужно знать и учитывать характер наследования дефектов, связанных с половыми хромосомами, чтобы отбирать для воспроизводства лошадей с минимальным риском генетических заболеваний. Мутации могут происходить и закрепляться в любой субпопуляции животных, особенно при замкнутой системе разведения и ограниченной по численности репродуктивной группе. На наследственное происхождение аномалии указывают такие факты, как соответствие клинических признаков лошади описанному генетическому дефекту, использование инбридинга даже в отдаленных степенях, появление подобных случаев у боковых родственников, в потомстве родителей и популяции в целом. Все случаи появления потенциально наследственных дефектов и заболеваний необходимо регистрировать, чтобы создать базу данных для проведения генетического анализа и осуществления службы генетического мониторинга.
Литература
1. Калашников В.В., Калинкова Л.В., Шемарыкин А.Е. и др. Тяжелый комбинированный дефицит арабских лошадей // Коневодство и конный спорт. - 2013, №5, C. 14-15.
2. Храброва Л.А. Генетические аномалии и болезни лошадей // Коневодство и конный спорт. – 2006, № 6, С.19-21.
3. Храброва Л.А. Наследственные болезни и дефекты лошадей. Методические указания по диагностике и профилактике. - Дивово, 2014, 31 с.
4. Andersson L.S., Juras R., Ramsey
D. T. et al. Equine multiple congenital ocular anomalies maps to a 4.9 megabase interval on horse chromosome 6 // BMC Genetics. – 2008, №8, P. 88-92.
5. Blanco A., Moyano R., Vivo J. et al. Purkinje cell apoptosis in Arabian horses with cerebellar abiotrophy // J Vet. Med. Physiol. Pathol. Clin. Med. - 2006, Vol. 53, №6, P.286-287.
6. Brooks M. Bleeding disorder (von Willebrand disease) in a quarter horse // J Am. Vet. Med. Assoc. – 1991, Vol. 1, №198, P.114-116.
7. Brooks S.A., Gabreski N., Miller D. et a l. Whole-genome SNP association in the horse: Identification of a deletion in myosin va responsible for Lavender Foal Syndrome // PloS Genet. – 2010, Vol.6, №4: e1000909, doi: 10.1371/journal. pgen1000909.
8. De Lahunta A., Glass E. Veterinary Neuroanatomy and Clinical Neurology. – 3nd Ed., Sanders, St. Louis, MO, 2009.
9. Finno C. J., Spier S.J., Valberg S.J. Equine disease by known genetic mutation // Veterinary J. - 2009, Vol. 179, P.336-347.
10. Junctional Epidermolysis Bullosa (JEB) Test (http://www.vglucdavis.edu/services/jeb.php). UC Davis, 2012.
11. Howden, K.J. Androgen insensitivity syndrome in a thoroughbred mare (64,XY -testicular feminization). Can. Vet. J. - 2004, Vol.45, P.501-503.
12. McCue M.E., Ribeiro W.P., Valberg S. Prevalence of polysaccharide storage myopathy in horses with neuromuscular disorders // Equine Vet. J. Suppl. 36, P. 340-344.
13. Nicolas F.M. Genetics of morphological traits and inherited disorders. The genetics of the horse / A.T. Bowling, A. Ruvinski. - Wallingford, 2000, P.71-83.
14. Nicholas F.M. Introduction to veterinary genetics. - 2-ed. Blackwell Publishing. Oxford Univ. Press, 2008, 282 p.
15. Online Mendelian Inheritance in Animal. Удаленный доступ: http://www.angis.org.au/omia/omia form.html
16. Orr N., Bask W., Gu J. et al. Genome-wide SNP association-based localization of a dwarism gene in Friesian draft horses // Animal Genetics. - 2010, Vol.41, Suppl. 2, P. 2-7.
17. Pailhoux E. Molecular analysis of an XY mare with gonadal disgenesis // Heredity – 1995, Vol. 122, P.109-112.
18. Raudsepp T., Darkin K., Lear T.L. et al. Molecular heterogeneity of XY sex reversal in horses // Animal Genetics. - 2010, Vol. 41, Suppl. 2, P. 41-52.
19. Revay T., Villagomez D.A., Brewer D. et al. GTG mutation in the start codon of the androgen receptor gene in a family of horses with 64,XY disorder of sex development // Sex Dev – 2012, Vol.6, Р. 108-116.
20. Shin E. K. Perryman L.E., Meek K. Meek Evaluation of a test for identiication of Arabian horses heterozygous for the severe combined immunodeiciency trait // Amer. Vet. Med. Assoc. - 1997, Vol.211, №10, P. 1268-1270.
21. Smith J.M., Meyers K.M., Barbee D.D. et al. Plasma von Willebrand factor in Thoroughbreds in response to high-intensity treadmill exercise // Am. J. Vet. Res. - 1997, Vol. 1, №58, P. 71-76.
22. Tryon R.C., White S.D., Bannasch D.L. Homozygosity mapping approach identiies a missense mutation in equine cyclophilin B (PPIB) associated with HERDA in American Quarter Horse // Genomics - 2007, №90, P.93-102.
23. Valberg S.J., Mickelson J.R. The interplay of genetics, exercise and nutrition in polysaccharidestorage myoparty // In: Proc. of the 25 Ann. Amer. College of Vet. Inter. Med. Conf. Seatlle. W.A - 2007, P.163-165.
24. Valentine B.A., Reynolds A.J, Ducharme N.G. et al. Six case reports: dietary therapy of equine polysaccharide storage myopathy / B.A. Valentine // Equine Pract. – 1996, №19, P.30-37.




Назад в раздел


















