Руководство по анестезии кошек Американской Ассоциации Врачей-Фелинологов'2018. Часть 1

Автор (ы): Мальцева Анна, редактор перевода; Клепикова Елена, перевод с английского
Журнал: №1 - 2019
Введение
На основании информации, которая у нас есть, кошки, подвергающиеся анестезии, по-прежнему имеют более высокую смертность по сравнению с собаками. В данном руководстве рассматриваются конкретные причины этого несоответствия и способы избежать периоперационных осложнений, связанных с мониторингом, контролем дыхания, инфузионной терапией и пробуждением. Кроме того, в руководстве обсуждаются другие важные аспекты анестезии кошек, в том числе, перианестетическая тревога и стресс, мониторинг, роль основных заболеваний, таких как гипертрофическая кардиомиопатия (HCM), правильное использование анестезирующего оборудования и тотальной внутривенной анестезии.
Хотя смягчение боли является неотъемлемой частью анестезии, методы анестезии не следует путать с лечением боли, что является предметом ранее опубликованных клинических рекомендаций. Использование обоих руководств (по анестезии и контролю боли – прим. ред.) позволит практикующему врачу обеспечить всестороннюю помощь до, во время и после анестезии.
Оборудование для анестезии: соображения безопасности для кошек.
Анестезирующее оборудование считается «жизненно важным», поскольку нарушение его работы или неправильное использование могут быть смертельно опасны для пациента.
В таблице 1 перечислены основные рекомендуемые расходные материалы и оборудование для анестезии кошек. Оборудование должно быть в хорошем состоянии и проверено в запланированные сроки (таблица 2).
Таблица 1. Анестезиологическое оборудование
Необходимое оборудование:
– внутривенные катетеры - 20 и 22 G;
– кислородные маски;
– эндотрахеальные трубки с глазом Мерфи (Murphy Eye необходим, чтобы при обструкции кончика трубки слизью было возможным дыхание через это отверстие); размеры (2,0-5,5 мм), с манжетой и без;

– ларингоскоп и соответствующий клинок: например, Miller, Cranwall или Seward, размер 0-2;
– аппарат для анестезии с автономным испарителем;
– закрытый контур для анестезии с манометром.
– предохранительный клапан безопасности;
– пищеводный стетоскоп;
– термометр;
– монитор артериального давления;
– пульсоксиметр с отображением плетизмограммы.
Рекомендуемое дополнительное оборудование:
– сигнал тревоги высокого давления в дыхательных путях;
– монитор ETCO2 с отображением капнограммы;
– инфузомат/шприцевой насос;
– ЭКГ-монитор.
Таблица 2. Текущее обслуживание оборудования для анестезии
|
Оборудование |
Плановое техническое обслуживание | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Дыхательные контуры |
– Тест на герметичность перед каждой анестезией – Очистка *: мыть в теплой воде между пациентами; сушить на воздухе | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Эндотрахеальные трубки |
Тест на герметичность ЭTT-манжеты перед каждым использованием – Очистка *: 1) Тщательно очистить внутри ЭTT используя кисть для бутылок и теплую воду 2) Выбросить, если у пациента есть респираторное заболевание | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CO2 абсорбер |
Заменить гранулы (гранулы становятся сухими после поглощения CO2 от пациентов и воздействия воздуха): 1)одиночные канистры – через каждые 8 часов использования; 2)должна быть установлена система для записи часов и даты использования (например, бирка, прикрепленная к канистре). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Аппарат для анестезии |
При необходимости очистить; заменять уплотнительные кольца и трубки ежегодно. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Испаритель |
При каждом выходе: согласно рекомендациям производителя: полное обслуживание: очистка внутри, испытание на герметичность под высоким давлением, замена деталей и перекалибровка каждые 3 года (требуется внешнее техническое обслуживание). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
* Часто используются дезинфицирующие средства, такие как Virkon (DuPont), хлоргексидин и перекись водорода; инструкции производителя для разбавления, времени контакта и промывки должны строго соблюдаться. Необходимость менять абсорбенты CO2 сильно варьируется и зависит от нескольких факторов, включая, но не ограничиваясь: размер контейнера, скорости потока кислорода и влажность. Если контролируется ЕТ CO2, можно отслеживать истощение абсорбента (одна из причин повышения уровня CO2 – это истощение абсорбентов CO2). Аппараты для анестезии и дыхательные контуры предназначены для доставки кислорода, ингаляционных анестетиков и предотвращения повторного вдыхания углекислого газа (CO2). Испытание на герметичность контура перед использованием у каждого пациента гарантирует, что кислород будет поступать пациенту и что будет минимальная утечка анестезирующих газов. Два основных элемента безопасности: 1) манометр и 2) предохранительный клапан сброса (рис. 1).
Рис. 1. Нереверсивный контур Бейна с встроенным манометром (белая стрелка) и предохранительным всплывающим клапаном (черная стрелка). Heidi Shafford
Манометр позволяет безопасно выполнять ручные и механические вдохи и контролировать соединение между манжетой эндотрахеальной трубки (ЭTT) и трахеей. Предохранительные клапаны безопасности предотвращают чрезмерное высокое давление в дыхательных путях и потенциальную баротравму. Эти устройства могут быть установлены на большинстве машин для анестезии для использования с реверсивными и нереверсивными контурами. Риск высокого давления в дыхательных путях значителен у кошек из-за их небольшого объема легких (~ 400 мл у кошки среднего размера). Высокие скорости потока кислорода, используемые в нереверсивных контурах, могут привести к повреждению дыхательных путей кошки менее чем за 30 сек.
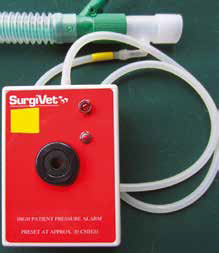
Другой вариант – вставить сигнализирующее устройство высокого давления между общим газовым выходом и контуром; устройство не позволяет выходить газу, но испускает громкий шум, если давление в контуре поднимается (рис. 2).
Рис.2. Пример сигнализирующего устройства высокого давления с батарейным питанием с адаптером (белая стрелка), который вставляется в конечную часть нереверсивного контура Бейна
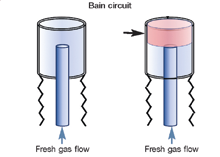
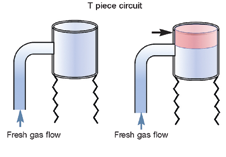
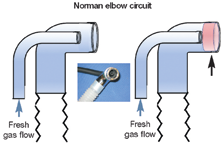
Ключевой момент Чтобы сделать анестезию кошек более безопасной, включите манометр и предохранительный клапан в дыхательном контуре пациента. Последний предотвращает быстрое увеличение давления в дыхательных путях и снижает риск баротравмы. Анестезирующие схемы Нереверсивные контуры широко используются в кошачьей анестезии, потому что они предлагают меньшее сопротивление, чем реверсивные, что является важным фактором для маленьких пациентов. Повторное вдыхание CO2 предотвращается высокими скоростями потока кислорода; Обычно рекомендуется использовать ⩾200 мл/кг/мин, но можно наблюдать за дыханием с помощью капнографа, позволяя установить скорость потока, чтобы вдыхаемый CO2 составлял <5 мм рт. ст. Другим преимуществом нереверсивного контура является минимальное мертвое пространство. Группа экспертов (работающих над данным руководством, – прим. ред.) рекомендует использовать нереверсивные контуры у всех кошек. Однако современные контуры с легкими пластмассовыми «reabreathing» (вовзратного дыхания) клапанами и минимальным мертвым пространством также могут безопасно использоваться у кошек >3 кг (6,6 фунта). Кнопка экстренной подачи кислорода (oxygen flush valve) никогда не должна использоваться, когда кошка подключена к нереверсивному контуру. Реверсивные контуры зависят от функциональных односторонних клапанов для обеспечения потока газа в одном направлении и абсорбентов CO2 для предотвращения повторного вдыхания CO2. Преимущества включают более низкие скорости потока кислорода (по сравнению с нереверсивным контуром), меньшее использование ингаляционных агентов и меньше отходов анестезирующего газа. Рекомендуется использовать педиатрические, а не взрослые дыхательные шланги, поскольку они имеют меньший объем мертвого пространства. В таблицах 3 и 4 приведено краткое справочное руководство по двум типам дыхательных контуров анестезии, предложенным значениям расхода кислорода и размерам резервуара (реверсивного) в зависимости от типа контура и веса тела кошки. Таблица 3. Сравнение реверсивных и нереверсивных контуров
Таблица 4. Минимальный поток кислорода и размер резервного мешка для кошек
* Более высокие скорости потока кислорода в первые 15 минут ускоряют скорость изменения концентрации ингалянтов в контуре дыхательного анестетика † Мониторинг выдыхаемого CO2 для оценки повторного вдыхания CO2 и потребности в более высоких или более низких расходах кислорода. При активной системе очистки может потребоваться более высокая скорость потока кислорода (это не повредит пациентам) Важно свести к минимуму количество мертвого пространства оборудования. К общим объемам мертвого пространства относятся конец дыхательных контуров пациента (рис. 3), адаптеры капнографа с боковым потоком (рис. 4), встроенные капнографы и коленчатые адаптеры. В то же время важно не увеличивать сопротивление дыхательных путей, поэтому диаметр адаптера капнографа должен всегда превышать внутренний диаметр ЭTT (рис. 4c). Чрезмерное мертвое пространство оборудования приводит к повторному вдыханию CO2 и снижает эффективный дыхательный объем, доступный для газообмена. Мертвое пространство должно составлять ⩽2-3 мл / кг, что составляет 20% от дыхательного объема.
Рис. 3. Мертвое пространство (красным, черные стрелки) дыхательного контура со стороны пациента у различных типов дыхательных контуров для анестезии. Любезно предоставлено Peter Pascoe
Рис. 4. Мертвое пространство, связанное с различными адаптерами капнографа
(a) Адаптер с боковым потоком для использования со съемной линией отбора проб; стрелка показывает ширину диаметра; (b) Адаптер «все в одном» с боковым потоком; стрелка показывает ширину диаметра; c) педиатрический адаптер; обратите внимание на небольшой диаметр просвета, как показано стрелкой. Диаметр адаптера капнографа должен всегда превышать внутренний диаметр ЭT; (d) Адаптеры ЭTT с низким мертвым пространством доступны для присоединения к линиям отбора проб бокового потока. Любезно предоставлено: Gregg Griffenhagen
Один коленчатый адаптер может содержать до 8 мл мертвого пространства, что может быть чрезмерным у маленьких кошек. Поэтому рекомендовано приобретать педиатрические схемы и адаптеры с малым мертвым пространством. Федеральное правительство США не установило официальных стандартов экологического контроля отходов анестезирующих газов. Администрация безопасности и гигиены труда (ОSHA) предоставляет консультативные рекомендации, а некоторые штаты США имеют конкретные правила. Данная группа экспертов настоятельно рекомендует очищать отходы анестетиков, в частности, с использованием активных систем, которые более эффективны, чем пассивные системы очистки (например, канистры с активированным углем). Для получения дополнительной информации см. Рекомендации Американской коллегии ветеринарной анестезии и аналгезии о контроле над обезвреживанием газов на рабочем месте: www.acvaa.org/docs/Position_ Statement. Преанестезиологичесая оценка Анамнез пациента Получение полной истории пациента у владельца может быть сложной задачей. Например, информация о потреблении пищи и воды, а также о мочеиспускании и дефекации может быть неизвестна у кошек, которые выходят на улицу, а также в домах с несколькими котами. Кошки часто не проявляют очевидных клинических симптомов на ранней стадии заболевания, потому что симптомы слабые и остаются незамеченными или считаются «нормальными» (например, уменьшенная подвижность с возрастом). Многие владельцы также не знают, что их «явно здоровая» кошка имеет ожирение или недостаточный вес. Поэтому тщательное физикальное обследование и соответствующие анализы перед анестезией важны для всех кошек, которым требуется общая анестезия. Процесс сбора анамнеза может быть улучшен за счет разработки стандартизированного вопросника или документа для обсуждений, например, такого, который представлен в AAFP-AAHA Feline Life Stage Guidelines. Догоспитальное применение габапентина настоятельно рекомендуется для многих кошек, чтобы уменьшить страх, стресс и облегчить физическое обследование. Габапентин используется как анксиолитик, чтобы уменьшить отрицательные эмоции, страх, которые могут привести к нежелательному поведению, включая агрессию. На рис. 5 и 6 приведены ключевые компоненты для работы с такими кошками.
Рис.5. Многошаговый протокол работы анестезиолога с агрессивными кошками Рисунок 6. Основные рекомендации для сведения к минимуму тревоги и облегчения обращения с кошками, поступающими для проведения процедур под анестезией Если процедура плановая, а кошка испытывает выраженный стресс, возможным вариантом является перенос процедуры с предварительным планом для коррекции страха до возвращения кошки в клинику. Без полного физикального осмотра риск недостаточной или неправильной диагностики сопутствующих заболеваний значительно увеличивается, тем самым повышая риск анестезии. Преанестезиологические лабораторные исследования Решение о проведении предоперационного обследования должно основываться на результатах анамнеза и физикального обследования, периоперационной оценке риска, клинических симптомах и практике. Отклонения от нормы в результатах обследований могут выявить проблемы, не обнаруженные при физикальном осмотре и сборе анамнеза, и привести к изменению плана анестезии. Минимальная база данных должна разрабатываться на основе индивидуальной оценки пациентов (табл. 5). Таблица 5. Рекомендованная база преанестезиологического обследования кошек на основании стадии жизни
Поскольку во время приема многие кошки подвергаются стрессу, физикальное обследование и лабораторные результаты могут отражать это, затрудняя интерпретацию. Например, уровень глюкозы в крови, сердечный ритм и кровяное давление могут повышаться как из-за стресса, так и из-за болезни. Если «кэт френдли» методы работы не сработали, в интересах пациента надо отказаться от физической фиксации, стоит рассмотреть седацию препаратами. Если седация применяется, врач должен понять, какое влияние могут оказать некоторые лекарства на физикальный осмотр и лабораторные данные. Одним из примеров является дексмедетомидин, который приводит к снижению частоты сердечных сокращений, изменениям в эхокардиограмме и повышению артериального давления и значений глюкозы в крови. Проведенное ретроспективное исследование преданестезиологических проб крови кошек со средним возрастом 11,6 лет показало, что примерно у 16% были ненормальные результаты, связанные с клиническими симптомами, и в 1% этих случаев не было выявлено никаких аномалий из анамнеза или физикального осмотра. В результате были изменены анестезирующие протоколы или процедура отложена в 9% случаев. Рекомендуется ежегодное обследование на гипертиреоз, начиная с 7-10 лет, поскольку это заболевание поражает до 10% кошек в возрасте от 10 лет и старше. В зависимости от анамнеза пациента, симптомов и результатов физикального осмотра могут потребоваться другие исследования, такие как электрокардиография, рентген грудной клетки, эхокардиография и NT-proBNP. Кардиомиопатия часто является «тихой» болезнью у кошек, и скрининг NT-proBNP следует рассматривать в группах риска. Сообщается, что этот тест имеет чувствительность в 90% и специфичность в 85% при обнаружении кошек с бессимптомной сердечной болезнью. Было также показано, что тест NT-proBNP помогает дифференцировать сердечную недостаточность от несердечной причины одышки и является полезным инструментом у кошек, которые не являются достаточно сохранными для других диагностических тестов, таких как рентгенография и эхокардиография. Голодная диета Цель предоперационного голодания – уменьшить объем содержимого желудка и предотвратить гастроэзофагеальный рефлюкс (ГЭР), регургитацию и аспирацию. Обычно рекомендуется отказ от пищи в течение 6-12 часов до анестезии или «ничего после полуночи», но это не основано на каких-либо доказательствах. Исследования по продолжительности голодания на ГЭР противоречивы у собак. Кормление маленькой порцией консервированного корма за 3 часа до операции уменьшило заболеваемость ГЭР в одном исследовании, а в другом – нет, а более короткие сроки голодания были связаны с менее кислым рефлюксом. Другие факторы, включая преданестезиологические и обезболивающие препараты, процедуру, возраст и положение во время операции также влияют на ГЭР. Длительное время голодания не обязательно гарантирует, что желудок кошки будет пустым. Стресс, размер пищи и недостаток влаги в пище могут замедлить опорожнение желудка. Поэтому анестезиолог всегда должен быть готов к периоперационной рвоте. Хотя у кошек нет данных, более короткие сроки голодания (3-4 час.) с обеспечением небольшого количества влажного корма за 3-4 часа до анестезии вполне допустимы по усмотрению врача. Вода должна быть доступна до момента премедикации. Темперамент пациента Повышенное выделение катехоламинов у испуганных или агрессивных кошек приводит к тахикардии, системной гипертензии и/или тахипноэ, которые могут увеличить риск, связанный с анестезией. По этим причинам эксперты подчеркивают важность аккуратного обращения и преднамеренного использования габапентина или другой медикаментозной седации, когда это необходимо. Хирургическая процедура и риск Авторы исследования по периоперационной смертности мелких домашних животных (CEP-SAF study) сообщили, что предполагаемая процедура (объем операции) и ее срочность были факторами риска смерти, связанной с анестезией. Низкие показатели смертности у молодых здоровых кошек на плановой кастрации подтверждают эти результаты. Индивидуальный план пациента У людей преанестезиологическое обследование включает, как минимум, изучение медицинской карты пациента, разговор с пациентом и осмотр, а при необходимости – анализы и консультации специалистов (Американское общество анестезиологической группы по преданестезиологической оценке). Отклонение от нормы при обследовании у клинически здоровых животных должны быть рассмотрены вместе с данными анамнеза и осмотра, поскольку они могут не быть клинически значимыми. Классификация по Американскому обществу анестезиологов (ASA) Классификация по ASA позволяет разделить пациентов на категории в зависимости от состояния их здоровья, а не для оценки возможных анестезиологических осложнений. Такая классификация важна для создания плана анестезии, который минимизируют риск, и класификация ASA является одним из способов достижения этой цели (таблица 6). Таблица 6. Классификация физического статуса ASA с примерами
Потенциальное наличие скрытых болезней у кошек означает, что трудно точно назначить им категории ASA. Поскольку состояние ASA является субъективным, эта группа экспертов не считает оценку необходимой для каждого пациента, хотя это может быть полезно при планировании анестезии. У кошек есть одно исследование, которое оценивало возраст и состояние ASA как предикторы анестезиологического риска. Оно показало, что именно статус ASA, а не возраст, является лучшим предиктором для анестезиологических осложнений. Кошки со статусом ASA 3 или выше имели значительно повышенный риск осложнений. Однако другое исследование показало, что возраст (>12 лет) был фактором риска, не зависящим от статуса ASA (ссылки на исследования можно посмотреть в оригинале руководства, которое находится в свободном доступе – прим. ред.). Этапы жизни Во время предварительной анестезиологической оценки и планирования нужно также учитывать особенности организма животного в зависимости от возраста. «Фелинфрендли» подход (дружелюбная и аккуратная работа с кошками, направленная на уменьшение стресса – прим. ред.) и риск гипотермии нужно учитывать у всех кошек. Новорожденные/педиатрические пациенты/котята (0-6 месяцев) Ограниченная способность метаболизировать препараты через ферментную систему P450 до 5-месячного возраста; предрасположенность к гипотермии во время анестезии; использовать методы снижения стресса и «фелинфрендли» техники. Молодые кошки (7 мес.-2 года) Риск гипотермии во время анестезии; использовать методы снижения стресса и «фелинфрендли» техники. Взрослые кошки (3-6 лет) Дозы препарата должны основываться на идеальном весе тела; кошки с избыточным весом, ожирением и с пониженным весом могут реагировать по-разному в зависимости от используемого лекарственного средства; риск гипотермии во время анестезии; использовать методы снижения стресса и «фелинфрендли» техники. Зрелые кошки (7-10 лет) Процесс старения отличается между кошками; вероятно наличие сопутствующих заболеваний; подвержены гипотермии во время анестезии; использовать методы снижения стресса и «фелинфрендли» техники. Пожилые/престарелые кошки (старше 10 лет) Более высокий риск смерти от анестезии у кошек >12 лет независимо от статуса ASA; более чувствительны к воздействию седативных и обезболивающих препаратов на гемодинамику и дыхание; ограниченные компенсационные ответы на гомеостатические изменения; подвержены гипотермии во время анестезии; использовать методы снижения стресса и «фелинфрендли» техники. Сопутствующие заболевания Цель этого раздела заключается в повышении осведомленности у практикующих врачей о существующей вероятности наличия сопутствующей болезни у пациента, и цель данного Руководства заключается в том, чтобы выделить существенные факторы, связанные с каждой сопутствующей болезнью. Очень важно всегда учитывать, что многие анестезиологические пациенты будут иметь сопутствующие заболевания; некоторые могут быть субклиническими (например, ГКМП) или не диагностированными до анестезии, а некоторые могут быть клинически выраженными и плохо контролируемыми. Гипертрофическая кардиомиопатия Использование альфа2-адренергических агонистов у кошек с ГКМП является спорным. Одно исследование (с использованием медетомидина) указывает на его положительный эффект и снижение обструкции выносящего тракта левого желудочка, которое является не редкой при ГКМП. Опасения при применении этой группы препаратов заключается в том, что увеличение постнагрузки, связанное с введением альфа2-адренергического агониста или стрессом, может уменьшить сердечный выброс у кошек с ГКМП. Еще одна проблема заключается в том, что один дексмедетомидин в отдельности или в сочетании с другими препаратами вызывает изменения размеров и функции предсердий и желудочков и может влиять на интерпретацию данных эхокардиографии и торакальных рентгенограмм. Преимущества альфа2-агонистов состоит в снижении стресса у пациента, предотвращении тахикардии и снижении потребности в ингаляционной анестезии. Эти преимущества могут превышать потенциальные риски применения низких доз альфа2-адренергических препаратов. Эхокардиографические измерения были зарегистрированы у здоровых кошек до и после внутримышечного альфаксалона (2 мг/кг) в сочетании с буторфанолом (0,2 мг/кг), что обеспечивало хороший кратковременный седативный эффект. Хотя различия, отмеченные для большинства эхокардиографических измерений, не были клинически значимыми после седации, это не было подтверждено у кошек с ГКМП. Гипертиреоз Поскольку гипертиреоз влияет на множество систем, желательно получить эутиреоидное состояние до плановой анестезии, начав антитиреоидный препарат за 2-3 недели до процедуры и перепроверяя общий уровень тироксина в конце этого периода. Это позволяет оценить почечную функцию, основанную на эутиреоидном состоянии. Если кошка с неконтролируемым гипертиреозом нуждается в экстренной анестезии для не связанной с гипертиреозом проблемы и имеет значительную тахикардию (>200 уд/мин), бета-блокатор, такой как атенолол 1 мг/кг п/о каждые 12-24 час., может быть начат до анестезии. Однако если во время анестезии частота сердечных сокращений возрастает выше 220 уд/мин с достаточной глубиной анестезии, начните постоянную инфузию (ИПС) эсмолола с загрузочной дозой 0,1-0,5 мг/кг в/в течение 1 мин., и далее ИПС 100-200 мкг/кг/мин. Заболевание почек Преданестезиологическая жидкостная терапия может иметь значение для восстановления нормоволемии и гидратации. Для выбора инфузионной терапии следует использовать рекомендации Международной Ренальной Организации (IRIS) (www.iris-kidney.com). Некоторые врачи предлагают перед анестезией у кошек со стадией заболевания почек IRIS ⩾ 3 внутривенное введение сбалансированного раствора кристаллоидов в течение 4 час. в дозе 3-5 мл/кг/ч или расчет, основанный на ежедневной поддерживающей дозе, исходя из формулы 80 × масса тела (кг) × 0,75:24 час. Очень важны проактивный мониторинг и поддержание нормального артериального давления до, во время и после анестезии. Внутривенную инфузию следует продолжать в поддерживающем объеме до тех пор, пока пациент не сможет есть и пить. Для кошек, получающих эналаприл, прекращение его приема за 24-48 час. до анестезии может снизить риск интраоперационной гипотензии. Сахарный диабет Как и при других сопутствующих заболеваниях, в идеале диабетические пациенты должны быть хорошо компенсированы до любой анестезирующей процедуры. Необходимость применения инсулина утром в день операции зависит от уровня глюкозы в крови. В настоящий момент есть следующие рекомендации: – если уровень глюкозы в крови составляет <8 ммоль/л (<145 мг/дл), никакого инсулина не требуется; – при значениях 8-15 ммоль/л (145-270 мг/дл) делают половину обычной дозы инсулина; – при глюкозе >15 ммоль/л (>270 мг/дл) вводят обычную полную дозу инсулина для данного пациента. Пациенты с диабетом должны быть запланированы первыми на анестезию, чтобы их можно было выписывать в тот же день для возвращения к нормальному режиму кормления и инсулина. Рекомендуется контролировать глюкозу до и во время анестезии (каждые 30 мин.). Может потребоваться проверка уровня глюкозы в процессе пробуждения, особенно если во время анестезии вводили инсулин и если пациент не ел. Если уровень глюкозы в крови падает ниже 3 ммоль /л (54 мг/дл), необходимо сделать в/в болюс глюкозы 0,25-0,5 г/кг; при значимой гипергликемии (>30 ммоль/л, 540 мг/дл) вводится обычная для данной кошки доза инсулина. При уровнях глюкозы в крови между этими крайними показателями, можно использовать сбалансированные растворы кристаллоидов с или без глюкозы (2,5-5%) на основании результатов мониторинга. Астма или болезнь нижних дыхательных путей Осложнения, связанные с седацией и/или общей анестезией, могут быть значительно больше у кошек с заболеванием нижних дыхательных путей. Хотя в ветеринарной медицине при астме нет конкретных протоколов анестезии, таких, как у людей, но все же есть несколько рекомендаций: Продолжать применение препаратов для лечения астмы до и после анестезии. – использовать седацию до анестезии (например, габапентин, буторфанол, ацепромазин) для снижения стресса; – если пациент переносит, то перед индукцией в анестезию преоксигенация 100% кислородом в течение 3-5 мин. с помощью лицевой маски или «flow-by» («поток» – т.е. просто трубка, из которой идет кислород – прим. ред.) – установите в/в катетер; – всегда будьте готовы к интубации; – не пытайтесь интубировать пока кошка не окажется на подходящей глубине анестезии; или, в качестве альтернативы, рассмотреть возможность использования супраглоточного девайса для дыхательных путей (SGAD, см. ниже), если процедура разрешает его использование; – следует контролировать сатурацию гемоглобина в артериальной крови (SpО2) и CO2 в конце выдоха (ET CO2), дополнительная кислородотерапия продолжается после анестезии, во время пробуждения, так же как и тщательный мониторинг. Эти пациенты могут быстро декомпенсироваться, поэтому анестезиологической бригаде необходимо заранее готовиться к этим случаям и иметь все потенциально необходимое оборудование и материалы, прежде чем начать седацию. Тербуталин (0,01 мг/кг п/к) уменьшает осложнения при бронхоскопии и бронхоальвеолярном лаваже, его применение стоит рассмотреть и при анестезии кошек с астмой. Начало действия после п/к введения составляет 15-30 мин., это надо учитывать при планировании анестезии. Ожирение Поскольку ожирение может влиять на фармакокинетические свойства препаратов, такие как объем распределения, биодоступность и клиренс, дозы анестезирующих препаратов должны основываться на идеальном весе тела кошки. Исследования смертности предполагают взаимосвязь между массой тела и исходом. Кошки весом более 6 кг в 3 раза чаще умирали во время периоперационного периода, чем кошки весом 2-6 кг. Преоксигенирование с использованием либо маски, либо потока кислорода может помочь увеличить время до десатурации, особенно у брахицефалических пород. Этим кошкам необходимо, чтобы их состояние оксигенации тщательно контролировалось в течение периода пробуждения, и может потребовать кислородотерапию после операции из-за недостаточно эффективного дыхания. Дегенеративные заболевание суставов Дегенеративное заболевание суставов (DJD) может присутствовать у кошек любого возраста, но чаще встречается у кошек от 12 лет и старше. Кроме того, клинические признаки обычно смазаны. Поэтому проявляйте осторожность при позиционировании пациента во время анестезии. Одно из исследований показало, что 68,8% кошек, отобранных для изучения дегенеративного заболевания суставов, также имели одновременное хроническое заболевание почек. Обструкция мочевого пузыря Несмотря на то, что одной из целей терапии у кошек с обструкцией является восстановление оттока мочи, одно лишь восстановление оттока, без коррекции дегидратации, электролитных нарушений связано с худшими прогнозами. Кроме того, если есть изменения на ЭКГ, связанные с гиперкалиемией, или концентрация калия в крови составляет >7 мг-экв/л (ммоль/л), необходимо немедленно проводить терапию для защиты миокарда и снижать концентрацию калия в крови до седации или анестезии. Может потребоваться одна или несколько следующих процедур: – глюконат кальция 10% 0,5-1,5 мл/кг в/в для стабилизации сердечной проводимости; в течение 5-10 мин. под контролем ЭКГ; – в/в инфузия сбалансированным раствором кристаллоидов для регидратации, разбавления внеклеточного калия и восстановления кислотно-щелочного баланса; – болюс в/в инсулина короткого действия 0,5 МЕ/ кг, плюс болюс 25% глюкозы в дозе 2 г глюкозы на 1 МЕ введенного инсулина; это способствует перемещению калия в клетки. После начальных болюсов может потребоваться дальнейшее введение глюкозы в виде инфузии с постоянной скоростью для профилактики гипогликемии (не обязательно использовать строго 25% глюкозу, можно разводить разводить 40% в 2 раза и использовать, таким образом, 20% глюкозу – прим. перев.) – может потребоваться седация для установки уретрального катетера; достаточно буторфанола 0,1-0,2 мг/кг (в/м или в/в), но иногда нужна дополнительная седация или общая анестезия. Также настоятельно рекомендуется сакро-кокцидеальная эпидуральная анестезия, ее легко выполнять, она обеспечивает обезболивание и увеличивает шансы на успех при катетеризации уретры. Пациент в критическом состоянии Оценка кошки в критическом состоянии в идеале начинается до того, как пациент прибывает в клинику. Информирование может происходить по телефону между владельцем и врачом. Врач задает конкретные вопросы, которые помогут бригаде заранее подготовиться к прибытию кошки. Необходимо получить историю болезни кошки, чтобы убедиться, что ранее не было заболеваний, которые могут повлиять на лечение. Стандартная памятка, в которой подробно описывается, как нужно принимать и оценивать пациента в критическом состоянии, является чрезвычайно важным инструментом, с которым должен быть знаком каждый врач клиники. Кроме того, все члены команды должны получить практическое симуляционное обучение с использованием разных сценариев пациентов, а также обучение по чрезвычайным ситуациям, связанным с кошками. Пройдя это, все знают, что делать, когда критический пациент оказывается в клинике. Ниже приводятся важные факты, которые следует учитывать при оценке кошки в критическом состоянии: – средняя кошачья грудная клетка может содержать 300 мл жидкости до появления респираторного дистресса; – легкое – это шоковый орган у кошек, а объем крови меньше, чем у собак; поэтому необходимо тщательно контролировать жидкостную терапию; – у кошек шок обычно приводит к брадикардии; – кошки имеют ограниченную способность сокращать свою селезенку во время кровотечения; – при плохой перфузии и отсутствии питательной поддержки, кошки могут быстро развить катаболическое состояние, которое делает высоким риск развития липидоза печени; – у кошки с судорогами должны быть оценены экстракраниальные и внутричерепные причины, потому что идиопатическая эпилепсия редко бывает у кошек; – острая сердечная недостаточность чаще проявляется в виде респираторного дистресса, обморока и / или пареза задних конечностей; Из-за присущей кошкам способности маскировать болезнь, многие кошки, которые обращаются на прием, уже находятся в критическом состоянии, а дополнительный стресс или неаккуратное обращение могут привести к внезапной смерти. По прибытии в клинику состояние кошки следует немедленно оценить на предмет нарушения жизненно важных функций. Основное внимание следует сосредоточить на респираторной, сердечно-сосудистой, неврологической и мочевыводящей системах. Сначала следует оценивать дыхательную и сердечно-сосудистую системы. Кошки, у которых дыхание с открытым ртом, повышенная частота дыхания и дыхание с усилием, как правило, имеют серьезные нарушения дыхания и имеют высокий риск внезапной смерти даже во время осмотра. Поэтому такие кошки должны быть немедленно помещены в кислородную камеру, если они имеются, или снабжены проточным кислородом с минимальной фиксацией. В течение этого времени технический специалист (ассистент врача – прим. перев.) должен наблюдать за кошкой и, как только дыхание улучшится, позвать врача, чтобы завершить осмотр. Если одновременно обнаружены значительные нарушения перфузии и неврологический дефицит, следует сначала нормализовать перфузию, а затем повторно оценить степень неврологического дефицита. Как только кошка стабилизируется, выполняется вторичный осмотр. Проводится тщательный полный физикальный осмотр от головы до когтей. В зависимости от того, что обнаружено во время осмотра, планируют дополнительное обследование. Очень важно все время держать владельца в курсе того, что происходит с пациентом. Если возникает опасное для жизни состояние, требующее немедленной операции, необходимо, в первую очередь, приложить все усилия для стабилизации пациента, особенно, при одновременной сердечной недостаточности, внутричерепной гипертензии, пневмотораксе и/или отеке легких. Предварительная оценка является чрезвычайно сложной для этих критически больных кошек, поэтому были разработаны чек-листы, чтобы гарантировать, что все параметры будут оцениваться и контролироваться своевременно. Хотя «Правило Кирби-20» было разработано в первую очередь для наблюдения за септическими пациентами, этот чек-лист использовался врачами в экстренных случаях в качестве инструмента для наблюдения за критическим пациентом, чтобы в случае ухудшения состояния пациента лечение можно было начать немедленно. Анестезия и седация При необходимости, для снижения тревоги и страха перед процедурой следует использовать специальные поведенческие техники и/или седацию до клиники. Однако некоторые кошки все равно потребуют седации, прежде чем их можно будет осмотреть Седация для манипуляций Для седации применяют транквилизаторы, седативные средства и анальгетики (таблица 7), часто с добавлением местных анестетиков, что позволяет проводить некоторые процедуры без общей анестезии; например, наложение повязки, рентгенографию и ультразвуковое исследование. Преимущества медикаментозной седации включают в себя: уменьшение необходимости физической фиксации, снижение стресса, более простой доступ к дыхательным путям и быстрое восстановление. Таблица 7. Препараты, используемые для процедур под седацией
* Примечание: подкожное введение приводит к непредсказуемому всасыванию и эффекту, а некоторые опиоиды, вводимые этим путем, вызывают больше тошноты и рвоты, чем при введении внутривенно или внутримышечно. † Обычно обеспечивает лучшее качество седации, чем другие опиоиды при использовании в качестве единственного агента ‡ Это не полный список всех возможных комбинаций, а скорее серия примеров часто используемых комбинаций препаратов. Дозы и отдельные препараты должны быть адаптированы к потребностям пациента и врача. Рекомендуются два подхода: – используйте седативные препараты, такие как дексмедетомидин, с ожиданием поверхностного эффекта; подумайте, достаточно ли этого для требуемой процедуры; – включите в смесь в низкой дозе анестетик (например, кетамин, альфаксалон, тилетамин / золазепам) для обеспечения хорошего седативного эффекта, который, если потребуется, обезболит животное в более высокой дозе Эффект опиоидов, бензодиазепинов и альфа2-агонистов является обратимым, что позволяет быстро вернуться в активное состояние. Кошкам всегда должно быть предоставлено место для укрытия, так как это часто уменьшает страх и беспокойство. Клетки могут быть снабжены картонными коробками, одноразовыми кроватями или кроватями «иглу»; чтобы кошку можно достать из клетки прямо в ее домике и сделать инъекцию. Другие методы фиксации агрессивных кошек для инъекции включают пересадку кошки из ее переноски или клетки в гуманную ловушку (рис. 8) или использование клетки для сжимания (рис. 9) для инъекции в/м; альтернативно. Если кошка находится в мягкой одноразовой сетчатой переноске, ее часто можно использовать с этой же целью. Окончание в следующем номере. Рис.8. Кошку можно пересадить из переноски в гуманную ловушку для в/м инъекций
(a) Дверь переноски была удалена, а сама переноска помещена рядом с гуманной ловушкой. Когда кошка перемещается из одной коробки в другую, акриловая дверь ловушки соскальзывает на место. Для инъекции защитный кожух для инъекций (на фото, с отверстиями и рукояткой, в [b]) используется для удержания кошки около задней части клетки, а в/м инъекция может быть выполнена через одно из отверстий. Предоставлено Шейлой Робертсон (Sheilah Robertson)
Рис. 9. Когда вы готовы к инъекции, один человек тянет ручки (красные) к себе, поэтому кошка не может развернуться и осторожно удерживается на месте; другой человек может затем сделать в/м инъекцию. Сдвигающиеся клетки доступны с верхними и торцевыми дверями. Предоставлено Шейлой Робертсон (Sheilah Robertson) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Назад в раздел