Новое об атопическом дерматите у собак
Еще фото
Автор (ы): Э. Пападогианакис, DVM, PhD, дипломант Королевского ветеринарного колледжа, профессор кафедры ветеринарии Национального института здравоохранения Греции, г. Афины
Журнал: № 1-2 - 2012
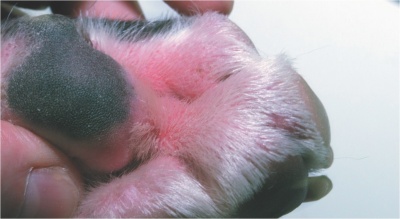
Атопический дерматит у собак (АДС) – одно из самых распространенных зудящих кожных заболеваний. Хорошо известно, что АДС – генетическое заболевание. Однако большинство исследований ставят во главу угла наследование гена, ответственного за выработку IgE. Несмотря на то, что определенные генетические предпосылки необходимы для развития болезни, они не являются достаточным условием. К возникновению заболевания приводит взаимодействие между средовыми влияниями и генами.
Патогенез
Патогенез заболевания довольно сложен и в некоторых отношениях недостаточно изучен, что оставляет место для не проверенных должным образом гипотез (например, вопрос о недостаточности дельта-6-десату-разы или атопическом антителе IgGd) и терапевтических рекомендаций, полагающихся на данные с недостаточной степенью доказательности.
Раньше АДС считали разновидностью немедленной гиперчувствительной реакции на вдыхаемые аллергены. Однако теперь известно, что собаки с генетической предрасположенностью к заболеванию вдыхают, и, возможно, переваривают аллергены (кроме того, эти аллергены проникают в организм животного через кожу), которые вызывают выработку аллерген-специфического IgE. Произведенный IgE связывается с тучными клетками дермы. При повторном столкновении с аллергеном происходит дегрануляция тучных клеток, сопровождаемая выбросом воспалительных медиаторов, включая гистамин. Некоторый положительный эффект от использования пищевых добавок с содержанием антигистаминов и незаменимой жирной кислоты (НЖК) послужил стимулом для дальнейших исследований патогенеза заболевания. При воздействии большинства антигенов активация Thl-лифоцитов, которые, в основном, вырабатывают IFN- и IL-2, приводит к производству IgG, в то время как активация Тh2-лифоцитов, которые, главным образом, вырабатывают IL-4 и IL-5, приводит к производству IgE, а не IgG. Какой именно ответ, Th1 или Th2, будет иметь место, предсказать сложно: это зависит от генетических и средовых факторов. Было обнаружено, что кожный покров собак с атопическим дерматитом отличается повышенной экспрессией IL-4. В последних исследованиях, у здоровых собак был обнаружен высокий уровень аллерген-специфического IgE, а у собак с плохой наследственностью и соответствующими симптомами (близкими к диагнозу АДС) IgE вообще не был обнаружен в сыворотке крови.
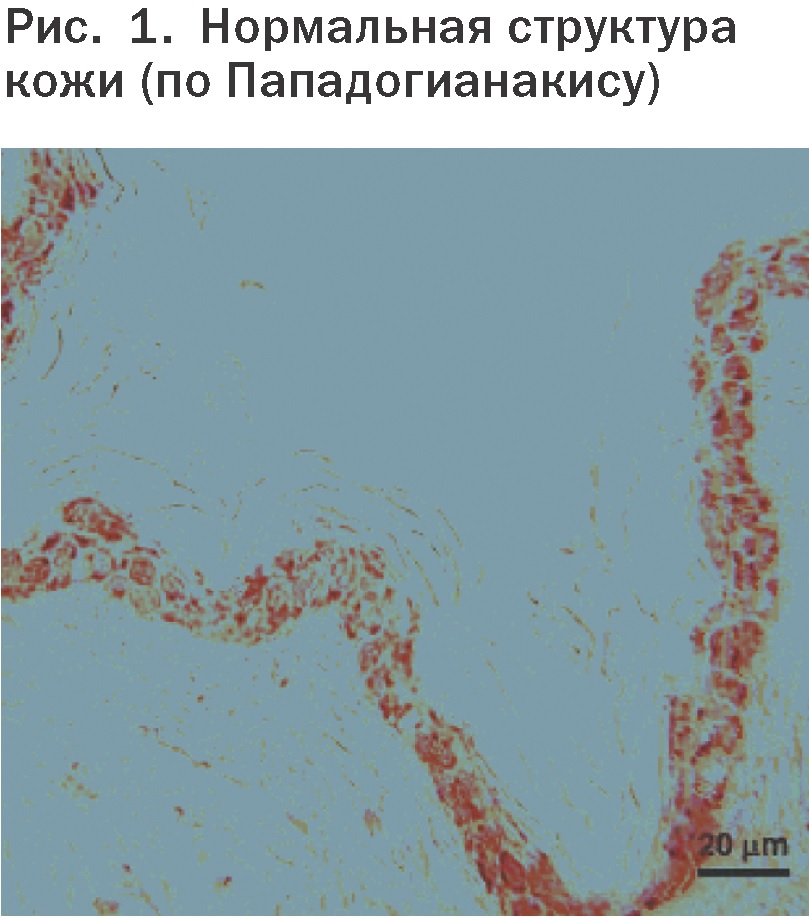
Согласно последним данным, при АДС имеется дисфункция кожного барьера.
Трансэпидермальная потеря влаги (ТЭПВ)
Несмотря на небольшое количество исследований ТЭПВ у собак, доказано, что ТЭПВ у собак с АД выше, чем у здоровых собак вне зависимости от того, спонтанное у них заболевание или экспериментально вызванное. Эти результаты, по всей видимости, указывают на повреждение кожного барьера, и в одном исследовании это связывают с пониженным содержанием церамидов в пораженной и здоровой кожной ткани.
Эпидермальные липиды
Исследователи установили, что уровень церамидов в пораженной и непораженной коже собак с АД значительно ниже, чем у здоровых собак. При этом разницы в уровне холестерина и свободных жирных кислот обнаружено не было. Недостаток церамидов, возможно, связан с повреждением кожного барьера.
Белки
В ходе эксперимента было показано, что у собак с искусственно вызванным АД иммуноокрашивание антителами к кожному филаггрину давало по сравнению со здоровыми животными аномально низкий результат.
Исследование ультраструктуры
Для здоровых и атопических собак установлены различия в ультраструктуре. У атопических собак, в отличие от здоровых собак, отмечаются серьезные аномалии липидных ламелл и выброс аморфного липидного материала как при искусственно вызванном, так и при спонтанном заболевании. При активации тучные клетки выбрасывают большое количество провоспалительных веществ и цитокинов. Цито-кины подводят воспалительные клетки к участку через 6-12 часов после активации тучных клеток (ответ поздней фазы). Этот ответ участвует в механизме хронического воспаления при АДС. Блокада H1-рецептора часто приводит лишь к незначительным улучшениям просто потому, что гистамин – только один из огромного множества воспалительных медиаторов, участвующих в патогенезе АДС.
Антиген-представляющие клетки – это клетки Лангерганса и дермальные дендритные клетки. Природа иммунологического ответа (под воздействием аллергена) отчасти зависит от типа рецепторов на антиген-представляющей клетке. У собак с АД и в эпидермисе, и в дерме был обнаружен подтип дендритных клеток с IgE и IgE рецепторами.
Активируясь, каждый кератиноцит выбрасывает более 30 цитокинов и других, связанных с ними, молекул. Кератиноциты собак с атопическим дерматитом, возможно, вырабатывают пониженное количество дефензинов, что, по крайней мере, частично может объяснить большую подверженность этих животных вторичным стафилококковым пиодермиям.
Бактериальная (обычно стафилококковая) пиодермия очень устойчива и часто рецидивирует у собак с АД. Исследователи обнаружили, что стафилококковые агенты могут проникать в роговой слой кожного покрова собак, вызывая производство IgE. Однако гипотеза о гиперчувствительности к стафилококкам у собак остается недоказанной. Стафилококковые экзотоксины, возможно, действуют как суперантигены, вызывающие мощную, прямую активацию лимфоцитов вне зависимости от молекул MHC-II. Эта активация приводит к продукции цитокинов и усилению воспалительного ответа в кожной ткани собак с АД.
Еще одно частое осложнение при АДС – это дерматит, вызванный возбудителем рода Malassezia. Было показано, что у собак существует медиированная IgE гиперчувствительность к Malassezia, которая может приводить к повышению чувствительности и усилению зуда. Влажная или жирная кожа в сочетании с сильным зудом, особенно зудом, не отвечающим на лечение глюкокортикоидами, - веское основание для проведения цитологического исследования на дрожжи. Количество дрожжей, обнаруженное в результате исследования, похоже, не отражает степень выраженности симптомов. При наличии симптомов даже один гриб, обнаруженный цитологическим исследованием, дает основание провести соответствующий курс лечения дерматита Malassezia.
Лечение
Глюкокортикоиды
Животные с АДС, как правило, хорошо отвечают на лечение глюкокортикоидами. Эти препараты подавляют множество генов, ответственных за производство цитокинов, цитокиновых рецепторов, хемокинов и адгезивных молекул, при том что антител (например, IgE) производится столько же, сколько раньше. С другой стороны, они активируют противовоспалительные гены (например, annexin-1). Гидрокортизон ацепонат и раствор Триамцинолона (в виде спрея) часто используются для местного лечения при АДС. Эти препараты особенно полезны для локализованных кожных поражений. Ими можно пользоваться только ограниченный промежуток времени, поскольку долгосрочное использование может привести к кожной атрофии, комедонам и образованию поверхностных фолликулярных кист. Если симптомы сильно выражены, то можно систематически использовать Преднизолон, Преднизон и Метилпреднизолон (0,5 мг/кг один или два раза в день до наступления ремиссии). Противопоказанием лечению является распространенная пиодермия. Долгосрочное применение может иметь тяжелые побочные эффекты. В случае отсутствия быстрого эффекта, вероятно, придется пересмотреть диагноз АДС.
Такролимус
Такролимус – это ингибитор кальциневрина, поставляется в виде мази 0,1% - эффективное лекарство, особенно при местном применении. Рекомендуется использовать два раза в день ежедневно в течение недели, а затем наблюдать за симптомами. Из-за отложенного действия препарата, рассчитанного на слабое раздражение, это лекарство плохо подходит для лечения обострений АДС.
Антигистамины
H1-блокаторы, в особенности сочетание хлорфенирамин-гидроксизин или Цетиризин могут оказаться полезны. Однако в активной фазе болезни они неэффективны, поскольку не успевают заблокировать гистаминовые рецепторы, которые к началу действия препарата оказываются уже заняты в результате гистаминового выброса. Кроме того, в патогенезе АДС помимо гистамина участвует множество других молекул. H1-блокаторы следует давать животному ежедневно в качестве профилактического средства, удерживающего H1-рецепторы в неактивном состоянии, чтобы не допустить обострений АДС. При использовании вместе с глюкокорти-коидами и незаменимыми жирными кислотами возможен синергетический эффект.
Незаменимые жирные кислоты в пищевых добавках
Для того, чтобы кислоты подействовали, они должны встроиться в клеточную мембрану, а на это уходит несколько недель. Согласно исследованиям, ежедневное употребление в пищу добавки с НЖК позволяет снизить эффективную дозу Преднизолона для лечения зуда при АДС. Однако по результатам нескольких исследований нельзя с уверенностью утверждать, что НЖК эффективны при АДС.
Phytopica®
Эта китайская пищевая добавка на растительной основе в дозе 200 мг/кг в день иногда позволяет снизить дозу Метилпреднизолона для лечения АДС и в то же время улучшает клиническую картину примерно на 20-50%. Зарегистрированные побочные эффекты минимальны (диарея легкой степени тяжести и рвота).
Циклоспорин A
Циклоспорин – это полипептид, выделенный из гриба Tolypocladiuminflatum. Это кальценевриновый ингибитор, ингибирующий действие многих цитокинов, которые участвуют в воспалительном процессе АДС. Препарат высокоэффективен при подавлении иммунного ответа (в дозе 5 мг/кг в день) и вызывает минимальные побочные реакции (даже при долгом использовании). Однако он дорого стоит. Использование вместе с Кетоконазолом значительно понижает требуемую дозу Циклоспорина и общую стоимость лечения. Ни в коем случае нельзя сочетать Циклоспорин с системными кортикостероидами, поскольку в результате такого лечения уже имели место случаи с летальным исходом из-за условно-патогенных грибковых инфекций.
Литература
1. DeBoer DJ, Hillier A. The ACVD task force on canine atopic dermatitis (XVI): Laboratory evaluation of dogs with atopic dermatitis with serum-based "allergy" tests. Vet Immunol and Immuno-pathol 2001; 81:277-287.
2. Farver K, Morris DO, Shofer F, et al. Humoral measurement of type-1 hypersensitivity reactions to a commercial Malassezia allergen. Vet Dermatol, 2005;16:261-268.
3. Hillier A, DeBoer DJ. The ACVD task force on canine atopic dermatitis (XVII): Intradermal testing. Vet Immunol and Immunopathol 2001; 81:289-304.
4. Marsella R. Atopy: New targets and new therapies. Vet Clin North Am Small Anim Pract 2006;36:161-174.
5. Olivry T, DeBoer DJ, Griffin CE, et al. The ACVD task force on canine atopic dermatits. Vet Immunol and Immunopathol 2001;81:143-383. (Note: This entire volume is devoted to an in-depth critical literature review on all aspects of canine atopy.)
6. Willemse T. Atopic skin disease: a review and reconsideration of diagnostic criteria. J Small Anim Pract 1986; 27: 771-778.




Назад в раздел


















