Обзор возможностей использования компьютерной томографии для диагностики интракраниальных новообразований у собак и кошек
Еще фото
Автор (ы):
Е. Л. Кемельман (1), С.А. Ягников (2,3), О.А. Кулешова (2),
1 - Клиника ветеринарной медицины «Айболит», г. Красногорск, МО. 2 - Центр ветеринарной хирургии «ВетПрофАльянс» (Москва, Чехов). 3 - Аграрно-технологический институт Федерального государственного автономного образовательного учреждения высшего образования «Российский университет дружбы народов» (Москва).
E. L. Kemelman [1], S.A. Yagnikov [2,3], O.A. Kuleshova [3]. 1 - Veterinary Clinic «Aibolit» (MR, Krasnogorsk). 2 - Center for Veterinary Surgery «VetProfAlliance» (Moscow, Chekhov). 3 - Agrarian Technological Institute of People's Friendship University of Russian (Moscow).
Журнал: №4 - 2016
Условные сокращения:
ГМ – головной мозг, КТ – компьютерная томография, МРТ – магнитно-резонансная томография, КВ – контрастное вещество.
Ключевые слова: собака, кошка, компьютерная томография, новообразование, головной мозг.
Keywords: dog, cat, computed tomography, tumor, brain.
Аннотация
В этой работе описываются 10 случаев визуализации интракраниальных новообразований у собак и кошек. Оценивалась визуальная картина новообразований и клинические признаки исследуемых животных.
Summary:
In this research article describes 10 cases visualization of intracranial neoplasms in dogs and cats. It describes the visual picture of the tumors and the clinical signs of the test animals.
Частота встречаемости
Интракраниальные новообразования у собак являются хорошо изученной патологией (Heidner G.L., 1991; Luginbuhl H., 1968; Zaki F.A., 1977). Данные по частоте встречаемости разнятся, ряд авторов сообщают в среднем о 14,5 случаях на 100 000 собак (Solleveld H.A., 1986; Vandevelde M., 1984; Withrow S.J., 2007). В другом исследовании частота встречаемости составила 3% (Snyder J.M. et al., 2006) и 4,5% (Song et al., 2013) соответственно. Song et al., 2013 также полагают, что неоплазии головного мозга (ГМ) встречаются еще более часто, и лишь трудности в проведении исследований (вероятно, автор имеет в виду не технические аспекты, а высокую стоимость КТ и МРТ в США и странах Западной Европы. – Прим. автора) обуславливают низкий процент встречаемости. Менингиомы являются наиболее частыми первичными новообразованиями ГМ у собак (Braund K.G., Ribas J.L., 1986; Motta L., et al., 2012; Sessums K., Mariani C., 2009; Withrow S.J., 2007). Наиболее часто менингиомы встречаются у пожилых собак, обычно старше 10 лет (Patnaik A.K., et al., 1986). Астроцитомы, олигодендроглиомы и олигоастроцитомы являются следующими по частоте встречаемости новообразованиями ГМ (Snyder J.M. et al., 2006; Summers B. et al., 1995). Недифференцированные саркомы, опухоли хороидного сплетения, медуллобластомы, нейробластомы, эпендимомы возникают реже (Nafe L.A., 1990), так, опухоли хороидного сплетения составляют 10% от общего числа интракраниальных неоплазий (Koestner A., Higgins R.J., 2002). Долихоцефалы, такие как шотландский терьер, староанглийская овчарка, доберман, золотистые ретриверы, более предрасположены к образованию менингиом (Bagley R.S., et al., 1998; Heidner G.L., 1991; Gavin P.R. et al., 1995). При этом исследования Song et al., 2013 не выявили породной предрасположенности у доберманов. Также отмечается предрасположенность золотистых ретриверов к опухолям хороидного сплетения (Westworth D.R. et al., 2008). Брахиоцефалические породы, такие как боксеры, бостон-терьеры, французские и английские бульдоги, английские той-спаниели, бульмастифы, более предрасположены к глиальным опухолям (LeCouteur R.A., 1999; Moore M.P., et al., 1996; Song et al., 2013).
У кошек проблема интракраниальных новообразований изучена не так хорошо. По данным Moore M.P. et al., 1996, у кошек частота встречаемости интракраниальных неоплазий 3,5 на 100 000 особей, другие авторы указывают частоту встречаемости 2,2% (Zaki F.A., Hurvitz A.I., 1976). Менингиомы являются наиболее частыми новообразованиями (LeCouteur R.A., 2001). Один из наиболее полных обзоров новообразований головного мозга у кошек был опубликован Troxel M.T. et al., 2003. В этом исследовании менингиомы также лидировали – 58,1%, лимфомы – 14,4%, опухоли гипофиза – 8,8%, глиомы – 7,5%. Первичные опухоли у кошек составили 70,6%, метастазы – 5,6%, прямое расширение вторичных по отношению к ГМ новообразований – 3,8%. 7,5% кошек имели 2 и более новообразования одного и того же типа, 10% кошек имели 2 различных типа интракраниальных новообразований. Средний возраст исследуемых кошек был 11,3±3,8 лет.
В отечественной ветеринарной практике также было описано использование КТ для визуальной диагностики веретеноклеточной астроцитомы у белоносой мартышки (Митрушкин Д.Е., Корнюшенков Е.А., Кулешова Я.А., Кривова Ю.В., 2010), использование КТ для диагностики и планирования хирургического лечения менингиомы у кота (Кулешова О.А., Ягников С.А. и др., 2010). Автор данной работы также имеет небольшой опыт использования КТ для диагностики интракраниальных новообразований у крыс (Кемельман Е.Л., Волкова Е.М. и др., 2016).
Визуальная диагностика
Именно с появлением КТ и МРТ в ветеринарной практике опухоли головного мозга у животных стали изучаться, диагностироваться и подвергаться лечению (Turrel J.M., Fike J.R., LeCouteur R.A., et al., 1986; Hu H., et al., 2015). На сегодняшний день эти методы являются стандартами диагностики новообразований головного мозга, и каждый метод имеет свои преимущества и недостатки. КТ имеет преимущество в диагностике образований, затрагивающих в том числе и костные структуры черепа. МРТ более чувствительна непосредственно к ткани головного мозга, в том числе к заболеваниям неопухолевой природы (LeCouteur R.A., 1999; Kraft S.L., Gavin P.R., 1999; Dickinson P.J., 2014). Тем не менее, в исследовании чувствительности именно к новообразованиям головного мозга КТ и МРТ показали примерно одинаковую (очень высокую) чувствительность (Kraft S.L., Gavin P.R., 1999; Runge V.M., Schiable T.F., Goldstein H.A., et al., 1988, Tidwell A.S., 1999; Tucker R.L., Gavin P.R., 1996). В исследовании Runge V.M., Schiable T.F., Goldstein H.A., et al., 1988 МРТ показала новообразования ГМ у 45 из 46 кошек, КТ выявила неоплазии ГМ в 13 случаях из 13. У людей и собак диагностическая точность КТ при обнаружении менингиом полости черепа составляет примерно 80% (Assefa et al., 2006; Polizopoulou et al., 2004). Диагностическая точность КТ при менингиомах полости черепа у кошек неизвестна. Чувствительность МРТ для правильной идентификации менингиом полости черепа собак варьирует от 66 до 100% (Thomas et al., 1996; Polizopoulou et al., 2004; Snyder et al., 2006; Ródenas et al., 2011), а у кошек оценивается как 96% (Troxel et al., 2004).
Информация, получаемая при визуализации головного мозга, важна и полезна не только с точки зрения обнаружения опухоли как таковой. Планирование хирургической резекции во время операции (Gallagher et al., 1995) и в послеоперационный период (Bergman et al., 2000; Forterre et al., 2007) также опираются на данные, полученные с помощью КТ и МРТ.
Основным недостатком обоих методов является низкая специфичность получаемой визуальной картины и невозможность определить (только предположить) тип новообразования. Из-за анатомических особенностей черепа (его замкнутого пространства) любая, даже доброкачественная опухоль должна быть удалена, так как несет прямую угрозу жизни животного. Однако в тех случаях, когда новообразование головного мозга не может быть удалено, понимание его морфологии является необходимым пунктом для планирования химиотерапии или лучевой терапии. Стереотаксическая биопсия головного мозга в данном случае становится, по сути, единственным методом прижизненной диагностики природы новообразования ГМ. Тема стереотаксической биопсии у животных на сегодняшний день развита крайне плохо. Всего было найдено несколько публикаций, посвященных использованию данной методики у животных: Anor S., Sturges B.K., et al., 2001; Chen A.V., Wininger F.A., et al., 2011; Giroux A., Jones J.C., et al., 2002; Koblik P.D., et al., 1999; Moissonnier P., Bordeau W., et al., 2000; Moissonnier P., Blot S., et al., 2002; Taylor A.R., Cohen N.D., et al., 2013; Troxel M.T., Vite C.H., 2008). В отечественной ветеринарной практике первый и пока единственный случай был опубликован Богатовым А.В., 2016. Из всех вышеперечисленных публикаций только одна (Chen A.V., Wininger F.A., et al., 2011) описывает использование МРТ навигации. Остальные публикации описывают использование КТ для навигационных систем.
Материалы и методы
Исследование было проведено на базе Центра биологии и ветеринарии РУДН и клиники ветеринарной медицины «Айболит», г. Красногорск. Для исследований использовался компьютерный томограф Picker PQ6000. В качестве контрастного агента выбран йогексол 350 мг/мл (омнипак, omnipaque, «Амершам Хелс, Корк»). Контрастное вещество вводилось непосредственно перед началом исследования с технической задержкой 10-15 сек.
Результаты
Описание исследованных животных и характеристика новообразований приведены в таблице 1. Всего новообразования головного мозга были визуализированы у 10 животных: 5 собак и 5 кошек. При этом у 1 собаки была диагностирована фибросаркома, остальные новообразования были интракраниальными. Четыре новообразования были дифференцированы с помощью гистологического исследования. Природа трех других была предположена на основании характерного анамнеза и визуальной картины. Три новообразования не были дифференцированы. Средний возраст исследуемых собак составил 8,2±0,73 года, кошек 7,2±1,49 года соответственно. Распределение по полу и у собак, и у кошек – 2 самца и 3 самки.
Во всех случаях неоплазии головного мозга хорошо визуализировались, однако лучшая визуализации паренхимы головного мозга, желудочков и гипофиза достигалась у пациентов, получавших йогексол в дозе 1050 мг/кг. В целом все визуализируемые образования имели хорошо очерченные контуры, определение их границ не вызывало затруднений.
Обсуждение и заключение
Данные литературы и собственные исследования показывают, что КТ, несмотря на худшую чувствительность к здоровой ткани головного мозга и заболеваниям неопухолевой природы, чем МРТ, является чувствительным методом для диагностики интракардиальных новообразований. Высокая чувствительность к костной ткани вкупе с высокодозным внутривенным контрастированием также расширяют визуальные возможности метода. Авторы видят различные тактики использования КТ в диагностике интракардиальных новообразований: с одной стороны, КТ может использоваться как скрининговый метод за счет очень высокой скорости исследования и низкой, относительно МРТ, стоимости исследования. Недостатком данного подхода является невысокая чувствительность КТ в отношении других заболеваний головного мозга. Другой вариант использования КТ – как уточняющего метода: планирование оперативного вмешательства на основе многоплоскостной и трехмерной реконструкции черепа, выполнение КТ ассистированной биопсии головного мозга для планирования лечения неоперабельных новообразований. Очевидно, что в идеальных условиях оба метода должны быть использованы, однако это накладывает определенную нагрузку на владельцев животного.
Таблица 1. Характеристика исследованных животных.
|
№ |
Жив. |
Пол |
Возраст |
Подтверждение |
Тип НО |
Доза КВ |
Визуальная характеристика |
|
1 |
Собака, метис (А) |
Ж |
9 |
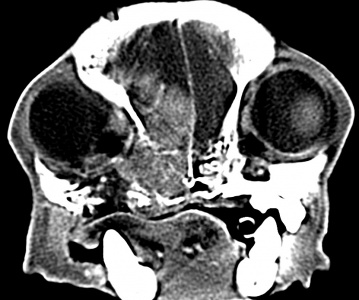
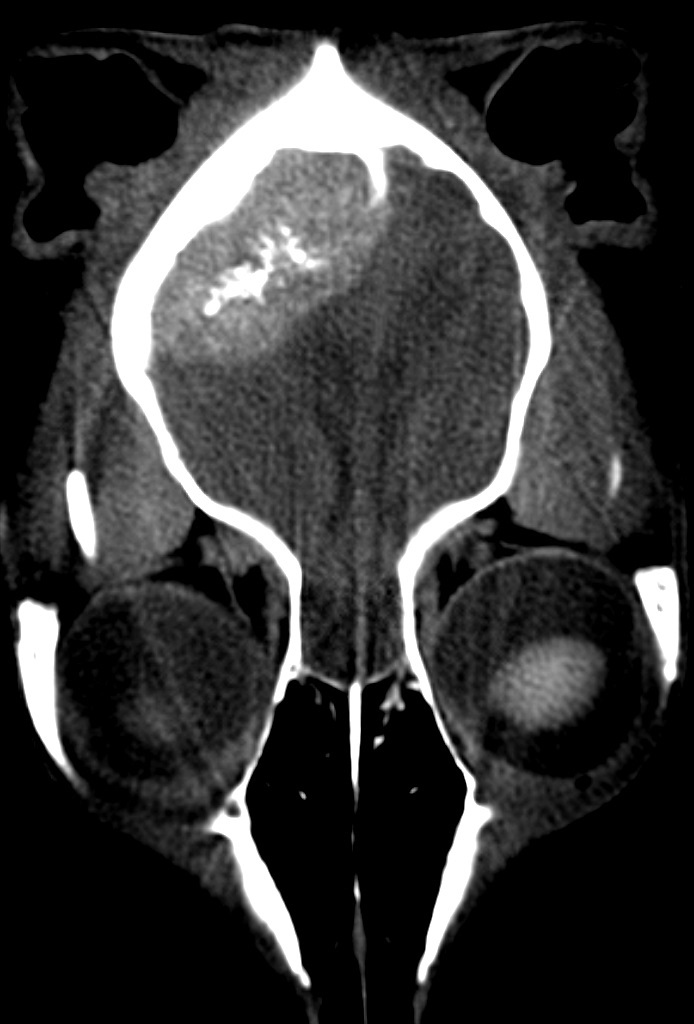
Только предположение. Гистология ОМЖ, метастазы в легких, множественные очаги в ГМ (рис. 1) |
Метастазы аденокарциномы |
700 мг/мл |
3 образования с выраженным накоплением КВ. D = 5мм, 6 мм, 10 мм. 2 образования обнаружены в больших полушариях, одно в обонятельной доле. Образования визуально очень похожи на метастазы в легких. Неврол. картина: нет. |
|
2 |
Собака, метис (Б) |
Ж |
9 |
Только предположение. Гистология ОМЖ, метастазы в легких, множественные очаги в ГМ |
Метастазы аденокарциномы |
700 мг/мл |
3 образования с выраженным накоплением КВ. Локализация: латеральные желудочки ГМ. D = 5 мм, 12 мм, 8 мм. Образования визуально очень похожи на метастазы в легких. Неврол. картина: нет. |
|
3 |
Собака, чихуа-хуа |
М |
6 |
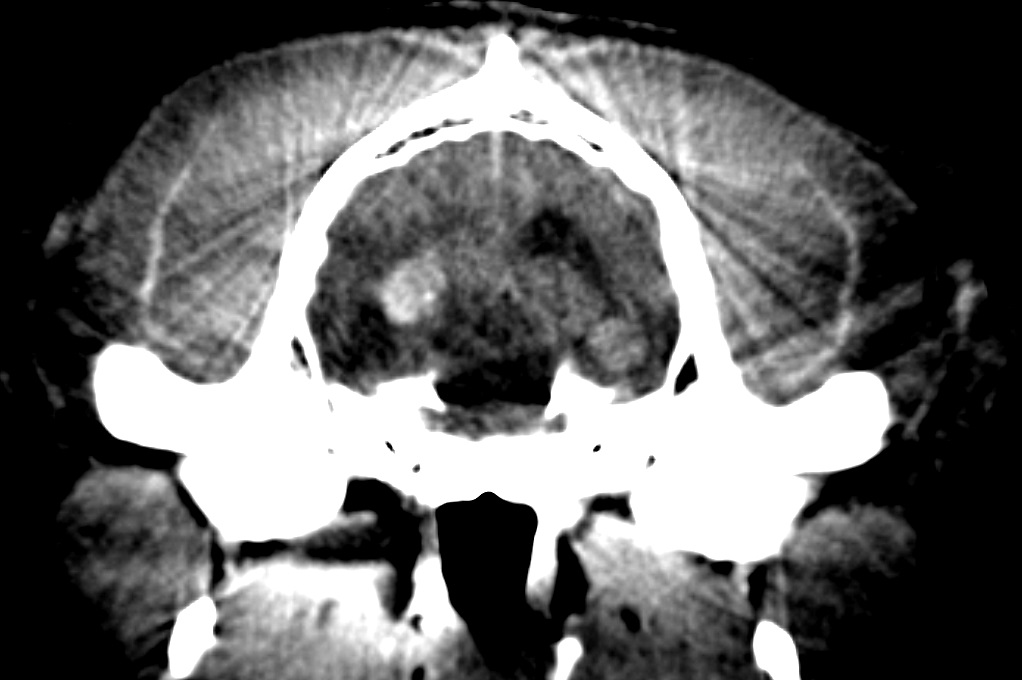
Гистология, полученная при риноскопии (рис. 2) |
Фибросаркома |
1050 мг/мл |
Новообразование с выраженной литической деструкцией костей, в том числе и решетчатой. Выраженное накопление контрастного вещества. Инвазия в обонятельные доли головного мозга. Неврол. картина: нет (только апатия). |
|
4 |
Собака, далматинец |
Ж |
10 |
нет |
нет |
350 мг/мл |
Два образования кистозной структуры с выраженным накоплением КВ по периферии. D = 8 мм, 15 мм, меньшее образование локализовалось рядом со средней линией ГМ, большее – под сводом черепа. Неврол. картина: эпилептиформные припадки. |
|
5 |
Собака, метис (Р) |
М |
7 |
нет |
нет |
700 мг/мл |
Крупное образование D=20мм с выраженным накоплением КВ. Центральная локализация непосредственно над турецким седлом, рострально от намета мозжечка. Неврол. картина: мозжечковая атаксия. |
|
6 |
Кошка, брит. |
М |
7 |
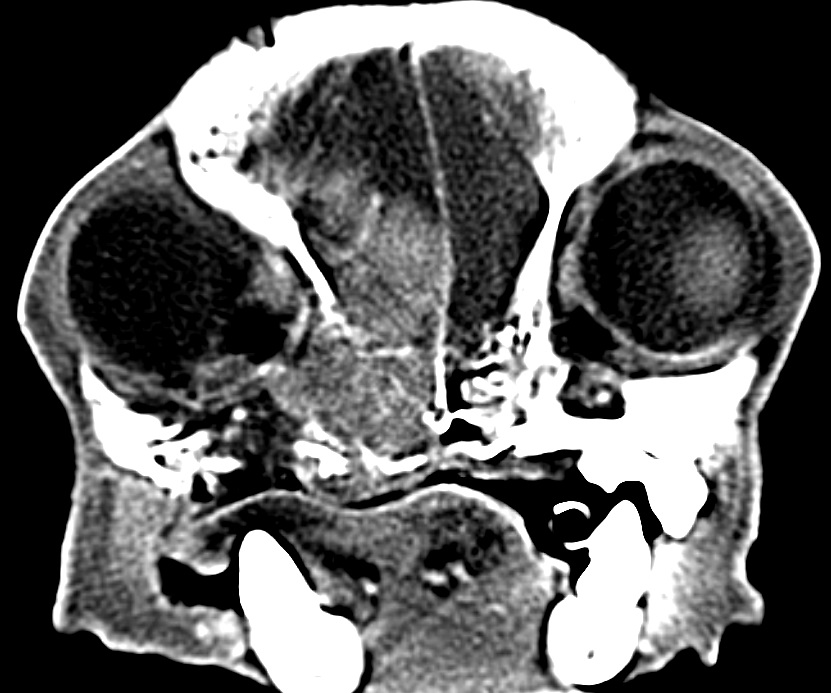
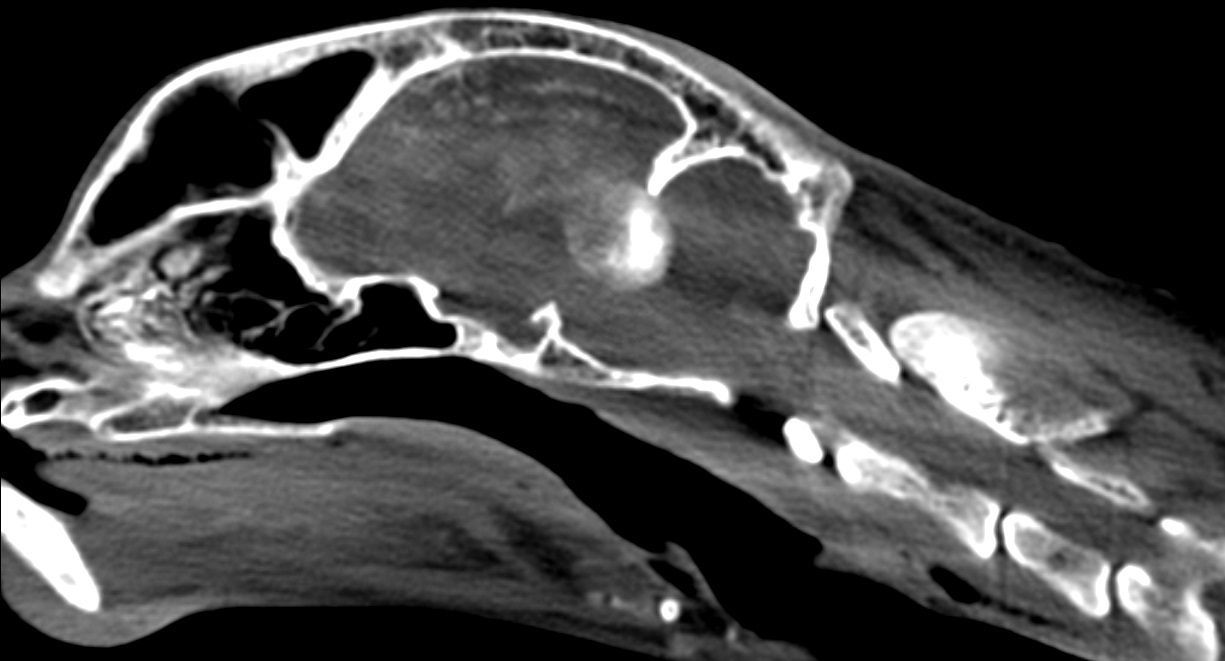
Только предположение. Характерная визуальная картина для аденомы гипофиза, синдром Кушинга (рис. 3) |
Аденома гипофиза |
700 мг/мл |
Минерализованное образование в области турецкого седла с накоплением КВ. Неврол. картина: недифференцированные приступы атаксии (со слов владельцев), длительностью примерно 1 ч. |
Литература
- Багатов А.В. Применение оптической навигационной системы в нейрохирургии. Наш опыт. Материалы 24-го Московского международного ветеринарного конгресса 2016. С. 81.
- Кемельман Е.Л., Волкова Е.М., и др. Использование компьютерной томографии для диагностики интракраниальных новообразований и оценка эффективности их консервативного лечения. РВЖ МДЖ. 2016; 1: 13–15.
- Кулешова О.А., Ягников С.А., Кемельман Е.Л., Леонова Т.А., Митрохина Н.В., Трубникова Е.А. Клинический случай оперативного лечения менингиомы у кошки. РВЖ МДЖ. 2010; 3: 29–36.
- Митрушкин Д.Е., Корнюшенков Е.А., Кулешова Я.А., Кривова Ю.В. Случай веретеноклеточной астроцитомы у белоносой мартышки. РВЖ, МДЖ. 2010; 2, 36–39
- Anor S., Sturges BK., et al. Systemic Phaeohyphomycosis (Cladophialophora bantiana) in a Dog—Clinical Diagnosis with Stereotactic CT-Guided Brain Biopsy. JVIM. 2001; 15.
- Assefa G., Ashenafi S., Munie T. Meningiomas: Clinical correlates, skull xray, CT and pathological evaluations. Ethiopian Medical Journal. 2006; 44: 263–267.
- Bagley R.S., Gavin P.R. Seizures as a complication of brain tumors in dogs. Clin Tech Small Anim Pract. 1998; 13: 179–184.
- Bergman R., Jones J., Lanz O., Inzana K., Shell L., Moon M., Wright R.E. Postoperative computed tomography in two dogs with cerebral meningioma. Veterinary Radiology and Ultrasound. 2000; 41: 425–432.
- Braund K.G., Ribas J.L. Central nervous system meningiomas. Comp Cont Educ Pract Vet. 1986; 8: 241–248.
10. Chen A.V., Wininger F.A., et al. Description and validation of a MRI-guided stereotactic brain biopsy device in the dog. VR&U. 2011, 0, 0, pp. 1–7.
11. Dickinson P.J. Advances in diagnostic and treatment modalities for intracranial tumors. J Vet Intern Med. 2014; 28: 1165–1185.12.Forterre F., Tomek A., Konar M., Vandevelde M., Howard J., Jaggy A. Multiple meningiomas: Clinical, radiological, surgical, and pathological findings with outcome in four cats. Journal of Feline Medicine and Surgery. 2007; 9: 36–43.12. Forterre F., Tomek A., Konar M., Vandevelde M., Howard J., Jaggy A. Multiple meningiomas: Clinical, radiological, surgical, and pathological findings with outcome in four cats. Journal of Feline Medicine and Surgery. 2007; 9: 36–43.
13. Gallagher J.G., Penninck D., Boudrieau R.J., Schelling S.H., Berg, J.Ultrasonography of the brain and vertebral canal in dogs and cats: 15 cases (1988–1993). Journal of the American Animal Hospital Association. 1995; 207: 1320–1324.
14. Gavin P.R., Fike J.R., Hoopes P.J. Central nervous system tumors. Semin Vet Med Surg. 1995; 10: 180–189.
15. Giroux A., Jones J.C., et al. A new device for stereotactic CT-guided biopsy of the canine brain design, construction, and needle placement accuracy. VR&U. 2002; 43 (3): 229–23.
16. Heidner G.L., Kornegay J.N., Page R.L., et al. Analysis of survival in a retrospective study of 86 dogs with brain tumors. J Vet Intern Med. 1991; 5: 219–226.17. Hu H., et al. Systematic Review of Brain Tumor Treatment in Dogs. JVIM. 2015; 29: 1456–1463.
18. Koblik P.D., et al. Modification and application of a pelorus mark 3 stereotactic system for CT-guided brain biopsy in 50 dogs. VR&U. 1999; 40 (4): 424–433.
19. Koblik P.D., LeCouteur R.A., et al. Modification and application of a pelorus mark 3 stereotactic system for CT-guided brain biopsy in 50 dogs. VR&U. 1999; 40 (4): 434–440.
20. Koestner A., Higgins R.J. Tumors of the nervous system. In: Meuten DJ, ed. Tumors of Domestic Animals, 4th ed. Ames, IA: Iowa State Press, 2002: 709–712.
21. Kraft S.L., Gavin P.R. Intracranial neoplasia. Clin Tech Small Anim Pract. 1999; 14: 112–23.
22. Le Couteur R.A. Current concepts in the diagnosis and treatment of brain tumours in dogs and cats. JSAP. 1999; 40: 411–416.
23. Le Couteur R.A. Cerebral meningiomas: diagnostic and therapeutic considerations. In August JR, editor: Consultations in feline internal medicine, vol. 4, Philadelphia: WB Saunders, 2001, . Р. 385–392.
24. Luginbuhl H., Frankhauser R., McGrath J.T. Spontaneous neoplasms of the central nervous system in animals. Prog Neurol Surg. 1968; 9: 85–164.
25. Moissonnier P., Bordeau W., et al. Accuracy testing of a new stereotactic CT-guided brain biopsy device in the dog. Res in Vet Sci. 2000; 68: 243–247.
26. Moissonnier P., Blot S., et al. Stereotactic CT-guided brain biopsy in the dog. JSAP. 2002; 43: 115–123.
27. Moore M.P., Bagley R.S., Harrington M.L., Gavin P.R. Intracranial tumors. Vet Clin North Am Small Anim Pract. 1996; 26: 759–777.
28. Motta L., Mandara M.T., Skerritt G.C. Canine and feline intracranial meningiomas: An updated review. Vet J. 2012; 192: 153–165.
29. Nafe L.A. The clinical presentation and diagnosis of intracranial neoplasia. Sem Vet Med Surg. 1990; 5: 223–231.
30. Patnaik A.K., Kay W.J, Hurvitz AI. Intracranial meningioma: A comparative pathologic study of 28 dogs. Vet Pathol 1986;23:369–373.
31. Polizopoulou Z.S., Koutinas A.F., Souftas V.D., Kaldrymidou E., Kazakos G., Papadopoulos G. Diagnostic correlation of CT-MRI and histopathology in 10 dogs with brain neoplasms. Journal of Veterinary Medicine A. 2004; 51: 226–231.
32. Runge V.M., Schiable T.F., Goldstein H.A, et al. Gd-DTPA clinical efficacy. Radiographics. 1988; 8: 147–159.
33. Rуdenas S., Pumarola M., Gaitero L., Zamora A., Aсor S. Magnetic resonance imaging findings in 40 dogs with histologically confirmed intracranial tumours. The Veterinary Journal. 2011; 187: 85–91.
34. Sessums K., Mariani C. Intracranial meningioma in dogs and cats: A comparative review. Compend Contin Educ Vet. 2009; 31: 330–339.
35. Snyder J.M., Shofer F.S., et al. Canine intracranial primary neoplasia 173 cases (1986–2003). J Vet Intern Med. 2006; 20: 669–675.
36. Solleveld H.A., Bigner D.D., Averill D.R., et al. Brain tumors in man and animals: Report of a workshop. Environ Health Perspect. 1986; 68: 155–173.
37.Song et al. Postmortem Evaluation of 435 Cases of Intracranial Neoplasia in Dogs and Relationship of Neoplasm with Breed, Age, and Body Weight. JVIM. 2013; 27: 1143–1152.
38. Summers B., deLahunta A., Cummings J.F. Tumors of the central nervous system. In: Veterinary Neuropathology. Mosby, Missouri: Elsevier, 1995: 351–401.
39. Taylor A.R., Cohen N.D., et al. Application and machine accuracy of a new frameless CT-guided stereotactic brain biopsy system in dogs. VR&U. 2013; 54 (4): 332–342.
40. Thomas W.B., Wheeler S.J., Kramer R., Kornegay J.N. Magnetic resonance imaging features of primary brain tumors in dogs. Veterinary Radiology and Ultrasound. 1996; 37: 20–27.
41. Tidwell A.S. Advanced imaging concepts: A pictorial glossary of CT and MRI technology. Clin Tech Small Anim Pract. 1999; 14: 65–111.
42.Troxel M.T., Vite C.H., Van Winkle T.J., et al. Feline intracranial neoplasia retrospective review of 160 cases (1985-2001). JVIM. 2003; 17: 850–859.
43.Troxel M.T., Vite C.H. CT-guided stereotactic brain biopsy using the kopf stereotactic system. VR&U. 2008; 49 (5): 438–443.
44.Tucker R.L., Gavin P.R. Brain imaging. Vet Clin North Am Small Anim Pract. 1996; 26: 735–58.
45.Turrel J.M., Fike J.R., LeCouteur R.A., et al. Computed tomographic characteristics of primary brain tumors in 50 dogs. JAVMA. 1986; 188: 1851–856.
46. Vandevelde M. Brain tumors in domestic animals: An overview. Proceedings, Conference on Brain Tumors in Man and Animals, Research Triangle Park, NC; 1984.
47.Westworth D.R., Dickinson P.J., Vernau W., et al. Choroid plexus tumors in 56 dogs (1985–2007). JVIM. 2008; 22: 1157–1165.
48. Withrow S.J., Vail D.M. Tumors of the nervous system. In: Small Animal Clinical Oncology, 4th ed. Elsevier: Saunders. 2007: 659–685.
49.Zaki F.A. Spontaneous central nervous system tumors in the dog. Vet Clin N Am Small Anim Pract. 1977; 7: 153–163.
50.Zaki F.A., Hurvitz A.I. Spontaneous neoplasms of the central nervous system of the cat. JSAP. 1976; 17: 773–782.


Назад в раздел


















