ПЕРВЫЙ ДОКУМЕНТИРОВАННЫЙ РОССИЙСКИЙ ОПЫТ ПРИМЕНЕНИЯ ФЛЮОРЕСЦЕНТНОЙ АНГИОГРАФИИ (ФАГ) В ВЕТЕРИНАРНОЙ ОФТАЛЬМОЛОГИИ
Еще фото
Автор (ы): Л.А. Соломахина, главный врач, врач-офтальмолог
Организация(и): Воронежский ветеринарный комплекс «Кот М@троскин»
Журнал: №4-2017
Флюоресцентная ангиография (ФАГ ) обеспечивает дополнительную информацию об основных поражениях, которые не видны при помощи обычной офтальмоскопии. Флюоресцеин вводится внутривенно, а затем прохождение красителя визуализируется, когда он проходит через сосудистую сеть глазного дна и связанные с нею ткани. Это дает ценную информацию о сетчатке и хориокапиллярной сосудистой системе, через которые флюоресцеин перемещается, а также указывает области ишемии, места сосудистых утечек, гипер- и гипофлюоресценции при различных поражениях. Однако данное исследование редко используется в ветеринарной медицине. До данной публикации в российской ветеринарной медицине отсутствовал документированный личный опыт применения данной методики.
Fluorescein angiography provides additional information about fundic lesions that are not visible by simple ophthalmoscopy. Fluorescein is injected intravenously and then the passage of the dye is visualized as it passes through the fundic vasculature and associated tissues. This provides valuable information about the retinal and choriocapillaris vascular systems through which the fluorescein travels and also indicates areas of ischaemia, sites of vascular leak age and hyper-and hypofluorescence a variety of lesions. However, this test is used infrequently in veterinary medicine. Prior to this publication in the Russian veterinary medicine there was no documented private experience with the application of this technique.
Метод исследования, получивший название флюоресцентной ангиографии глазного дна (ФАГ), приобрел особое значение в вопросах диагностики и патогенеза различных поражений сетчатки и хориоидеи. ФАГ преодолела ранее недосягаемый барьер и позволила изучать микроциркуляцию глаза in vivo. ФАГ широко используется в гуманной медицине, и есть масса медицинской литературы на данную тему. Данная техника ограничена в ветеринарии из-за проблемы фиксации пациента (из нашей практики это
не является сложностью), дорогостоящего оборудования, а также проблемы, связанной с различиями в анатомии (степень пигментации и наличие у животных тапетума). Очевидно, что, несмотря на вышеперечисленные сложности, метод может стать более широко используемым в специализированных центрах в будущем.
Флюоресцеин, введенный внутривенно, контрастирует сосуды переднего отрезка глаза, хориоидеи и сетчатки, что можно зарегистрировать фотографически. ФАГ является основой диагностики в лечении сосудистых заболеваний сетчатки и патологии пигментного эпителия.
Диагностическое применение и показания к ангиографии
• Хориоретиниты.
• Диабетическая ретинопатия.
• Гипертензивная ретинопатия.
• Ретинопатия недоношенных.
• Дегенеративные изменения в аrea
centralis.
• Окклюзия сосудов сетчатки.
• Ретинальные артериальные анев-
ризмы.
• Дистрофия пигментного эпителия
сетчатки.
• Хориоидальные опухоли.
• Наследственная дистрофия сет-
чатки.
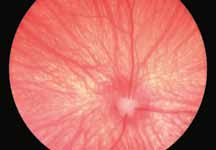
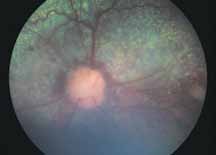
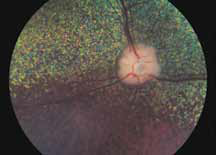
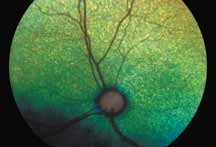
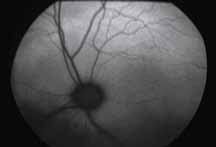
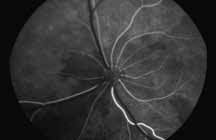
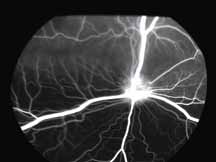
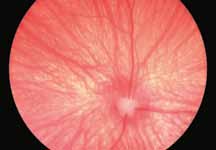
• Поражения ДЗН (неврит ДЗН, па-
пилоэдема и т.д.) (рис. 2).
Метод также может быть использован для обследования переднего сегмента, например при поражениях радужки (передние увеиты), но менее информативен при исследовании темных радужек, что исключает из исследования большинство собак. Кроме того, метод применяется для мониторинга прогрессирования заболевания и оценки эффективности терапии.
Для получения хороших ангиограмм существенное значение имеют использование современной фундус-камеры с высокой скоростью фотографирования, контакт с пациентом, прозрачность сред глаза, концентрация, количество и способ введения флюоресцеина. Для корректной интерпретации данных полученных ангиограмм необходимо детальное знание анатомии сетчатки, глазного кровотока, а также свойств флюоресцеина.
Свойства флюоресцеина
Флюоресцеин – слабая двухосновная кислота из группы ксантенов, используется в виде натриевой соли, хорошо растворимой в воде
(рис. 1). Возбуждение флюоресцеина в кровеносных сосудах глазного дна пациента происходит под действием света от лампы-вспышки камеры, который проходит через фильтр, пропускающий только свет с длиной волны 465–490 нм. Между глазом пациента и электронным фиксирующим устройством устанавливается барьерный фильтр, который пропускает только свет с длиной волны 520 нм, излучаемый флюоресцеином. При введении в кровь 80–85% флюоресцеина связывается с альбуминами плазмы и не флюоресцируют. Однако эти связи слабые и лабильные, значительно зависят от температуры и рН крови. Благодаря небольшим размерам молекулы и низкой молекулярной массе флюоресцеин легко проникает через большинство биологических мембран путем диффузии. Около 20% несвязанного вещества не проникают через гематоэнцефалический и гематоретинальный барьеры и при определенных условиях флюоресцируют.
Методика проведения ФАГ
Важно помнить, что 90% полезной информации получают в течение первых 30 секунд исследования. Поэтому крайне желательно, чтобы исследование проводилось натощак, так как зачастую на введение может возникать рвота, и в этот момент можно упустить чрезвычайно важную для врача информацию. Обычно рвота возникает
непосредственно «на игле», и пока подставляется кювета, убираются рвотные массы с морды животного, ценнейшие минуты исследования теряются, поэтому я настоятельно рекомендую выдавать владельцам животных памятки по подготовке к данной процедуре. Безусловно, исключения составляют случаи, когда необходимо
провести внеплановое исследование без голодной диеты. В этой ситуации мы вводим противорвотные и антигистаминные препараты и приступаем к исследованию.
Еще одним важным нюансом является расширение зрачка перед ФАГ.
Несмотря на то что современные фундус-камеры позволяют проводить осмотр глазного дна и на узком зрачке, полноценную оценку периферических участков сетчатки можно получить только при достижении мидриаза. Для расширения зрачка перед исследованием мы применяем мидриацил 1% (тропикамид 1%), который обеспечивает быстрый и относительно кратковременный мидриаз, необходимый для проведения процедуры. Основными противопоказаниями к расширению зрачка являются сублюксация хрусталика и наличие у животного на момент исследования офтальмогипертензии. Бывают ситуации, когда мы проводим ФАГ на узком зрачке у
собак с первичными глаукомами на фоне применения препаратов группы аналогов простагландинов F2α, которые вызывают миоз. Такие исследования тоже информативны, но гораздо сложнее в осуществлении.
Перед проведением ФАГ владельцам животного необходимо подписать информационное согласие на проведение процедуры. Далее проводятся взвешивание животного,
постановка внутривенного катетера, расчет дозы антигистаминных и противорвотных препаратов, а также флюоресцеина для введения.
Необходимо приготовить лоток на случай возникновения у животного рвоты и реанимационный набор на случай анафилактической реакции (адреналин, дексаметазон, димедрол, нашатырный спирт и т.д.). Для ФАГ людям вводят внутривенно 10% раствор флюоресцеина натрия в дозе 5 мл. Доза инъекционного флюоресцеина для внутривенного введения животным составляет 10–20 мг/кг. Всем исследованным нами животным вводилась доза 10 мг/кг. Данная доза не вызывает выраженных побочных эффектов и является информативной. В качестве подготовительной терапии перед проведением ФАГ рекомендовано ввести ондансетрон и димедрол/бенадрил
(дифенгидрамин). Ондансетрон (Зофран и т.д.) относится к группе противорвотных и серотонинергических средств. Эффективно предупреждает и устраняет тошноту и рвоту. Механизм действия обусловлен способностью ондансетрона селективно блокировать серотониновые 5-HT3-рецепторы. Раствор для инъекций содержит 2 мг/мл
действующего вещества. Препарат вводится в дозе 0,5–1,0 мг/кг внутривенно за 30 мин до введения флюоресцеина. Димедрол (дифенгидрамин) относится к противоаллергическим средствам, блокаторам Н1-гистаминовых рецепторов. Раствор для инъекций содержит 10 мг/мл действующего вещества. Препарат вводится в дозе 1–2 мг/кг внутримышечно за 30 мин до введения флюоресцеина.
Когда все готово для проведения процедуры, животное фиксируется ассистентом в удобном для исследования положении в затемненном помещении. Необходимо постараться не менять положения головы животного при ФАГ, так как в этом случае тратится драгоценное время. Из нашей практики даже для спокойных пациентов
иногда это является технически сложным, так как если неправильно выбран фокус или животное дернулось, важнейшие начальные кадры будут упущены. Поэтому для сравнения удобства получения снимков была опробована ФАГ с применением глубокой седации или общей анестезии.
В этой ситуации мы столкнулись с проблемой высыхания роговицы в ходе общей анестезии, что требовало периодического моргания за пациента и увлажнения его роговицы физиологическим раствором. Попытка нанесения на роговицу вязких лубрикантов с целью более длительного увлажнения несколько нарушала четкость полученных фото. В остальном, безусловно, проводить данное исследование на седированных пациентах, с одной стороны, было более комфортным, но с другой стороны, у ряда пациентов возникал пролапс третьего века и «закатывание» глаз, что добавляло сложностей в их фиксации.
В случаях если врач должен применять наркоз для проведения ФАГ, необходимо взвесить вероятную полезность информации против трудностей получения этих данных и вероятных побочных эффектов. Из личного опыта применение ФАГ у большинства неседированных пациентов не представляет сложности и вполне реально в осуществлении, требуется только опыт работы с фундус-камерой конкретной модели с целью получения четких цветных снимков, и только после этого имеет смысл работать в направлении ФАГ.
После фиксации животного ассистентом врач или второй ассистент вводит раствор флюоресцеина в вену (удобнее использовать головную (подкожную) вену предплечья). Перед введением красителя чрезвычайно важно проверить проходимость катетера, так как необходимо убедиться, что контрастное вещество попадет точно в вену. При проникновении контрастного вещества в жировую ткань рядом с веной (экстравазация контрастного вещества) у животного могут возникнуть болевые ощущения и выраженная местная воспалительная реакция. В данном случае рекомендована местная инъекция стероидов.
Краситель вводится достаточно быстро, в течение 3–5 с. Первая фотография делается в конце инъекции, чтобы от нее можно было отсчитывать точное время для интерпретации ангиограммы. Далее производится серия из 30 снимков, сделанных за первые 30 с, то есть 1 фото в 1 с, если это позволяет оборудование, или же 1 фото каждые 5 с. Самыми информативными являются первые 30 с исследования. За серией снимков, полученных в этот промежуток, следуют единичные фотографии через 20 и 30 минут. Таким образом, исследование занимает около 20–30 минут от момента введения красителя.
Осложнения и побочные эффекты ФАГ
Осложнения ФАГ встречаются редко, но в клинике обязательно должны быть препараты для их устранения.
Среди наиболее частых осложнений – тошнота и рвота. Как уже было сказано выше, рвота наиболее часто возникает у животных, которым исследование проводилось не натощак или без предварительного введения противорвотного препарата. Животные, которые поступают на исследование на голодный желудок или с предварительным введением противорвотного препарата за 30 мин до исследования, крайне редко проявляют тошноту и рвоту, которые начинаются достаточно быстро после введения красителя и быстро проходят. Тем не менее, перед исследованием кювета на случай рвоты должна быть наготове. По данным медицинской статистики, примерно у одного из пятисот пациентов могут развиться зуд и крапивница. Они обычно начинаются после окончания ангиографии. На данный момент нами было исследовано более 50 пациентов, и ни у одного не наблюдались зуд и крапивница.
Возможно, это связано с введением нами антигистаминного препарата за 30 мин до процедуры.
Также у людей описаны артериальная гипотония и нарушения сердечного ритма, флебиты, но они встречаются редко. Кроме того, в медицинской практике были описаны даже смертельные исходы, хотя это чрезвычайная редкость. Безусловно, флюоресцеиновый краситель, как и любой другой препарат, может вызвать индивидуальную анафилактическую реакцию, поэтому крайне важно для профилактики данного осложнения применять антигистаминные препараты перед введением.
Перечисленные ниже побочные эффекты встречаются при каждом исследовании, не являются проблемой, но требуют информирования
владельца.
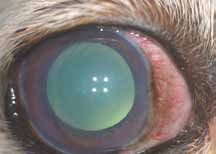
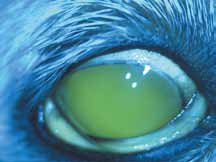
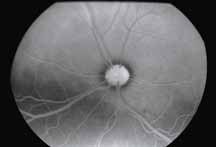
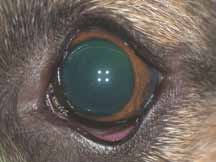
1. Легкая желтушность кожи и слизистых оболочек. Данное состояние возникает потому, что сосуды кожи не обладают непроницаемыми стенками и при введении флюоресцеин будет поступать в ткани. Окрашивание кожи и слизистых оболочек достигает максимума через 10 мин после введения, освобождение тканей от флюоресце-
ина происходит в течение 24–48 часов (рис. 3).
2. Яркий желто-оранжевый цвет мочи. Данное состояние связано с выведением красителя из организма почками. Краситель быстро выводится из организма в течение суток при отсутствии почечной недостаточности.
3. Ярко-желтое окрашивание сыворотки крови. При необходимости отправки крови в лабораторию необходимо предупредить об этом персонал.
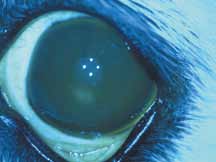
4. Легкое окрашивание ВГЖ, которое становится явным в случае выраженного переднего увеита (рис.4.1–4.2).
Нормальная флюоресцентная ангиограмма
Распределение флюоресцеина в тканях глаза изучали ряд исследователей с использованием ангиографических и гистологических методов. Выявлено, что структуры, образующие гематоофтальмический барьер, в норме не пропускают флюоресцеин. К ним относятся сосуды сетчатки, имеющие плотный слой эндотелиальных клеток, связанных между собой особо прочными межклеточными соединениями, и слой пигментного эпителия, где практически отсутствуют интерцеллюлярные пространства. В
то же время флюоресцеин свободно проникает через фенестрированную стенку хориокапилляров и накапливается в экстравазальных пространствах хориоидеи, окрашивает мембрану Бруха (базальная пластинка сосудистой оболочки глаза) и склеру. Слой пигментного эпителия задерживает переднюю диффузию флюоресцеина
из хориокапиллярного слоя. Функционирующие в норме барьеры для проникновения флюоресцеина в сетчатку разрушаются при патологических состояниях, что имеет принципиальное значение для интерпретации флюоресцентных ангиограмм.
По медицинским данным, при введении препарата в локтевую вену время прохождения красителя от момента введения в вену до появления его в сетчатке в норме составляет 10–12 с. В зависимости от места введения время может увеличиваться на 5–10 с. Это время варьируется в зависимости от вязкости крови и минутного объема сердца. При задержке поступления красителя более чем на 30 с необходимо переместить фундус-камеру к другому глазу пациента и посмотреть, заполняются ли сосуды
в нем. Таким образом можно выявить обструкцию внутренней сонной или глазной артерии. У животных время прохождения красителя от момента введения в вену до появления его в сетчатке в среднем составляет 5–50 с в зависимости от вида животного и сердечно-сосудистых факторов.
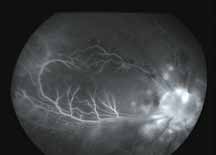
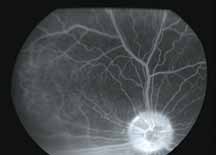
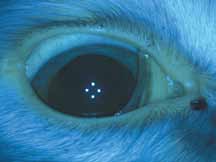
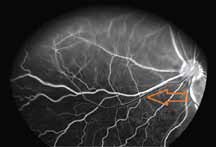
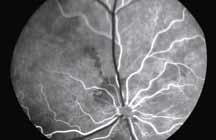
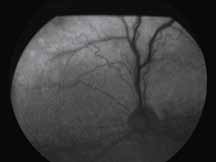
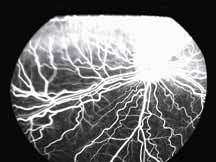
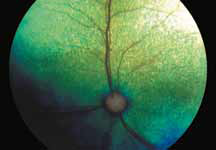
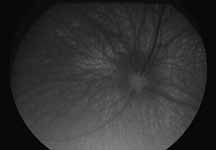
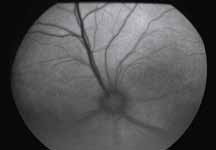
Исследование начинается с получения снимков в бескрасном свете до введения инъекции флюоресцеина. На таких фото можно выявить аутофлюоресценцию. Далее вводим флюоресцеиновый краситель, который проходит следующие фазы (деление условное; различные источники предлагают разные вариации) (рис. 5– 8).
1. Хориоидальная фаза
В норме наблюдается неравномерное пятнистое заполнение хориоидального русла. Однако вся хориоидея должна заполниться уже к ранней артериальной фазе, то есть на флюоресцентной ангиограмме хориоидальное русло заполняется в первую очередь. Важно не расценить неравномерное заполнение хориоидеи как гипофлюоресценцию в ранней хориоидальной фазе. Выраженность видимой флюоресценции зависит от количества естественного пигмента в пигментном эпителии сетчатки (RPE). Чем больше пигмента в RPE, тем хориоидальная вспышка будет заметна меньше, и чем меньше пигмента в RPE, тем проще увидеть хориоидаль-
ную фазу. В случае субальбинотического глазного дна (светлое глазное дно) контраст между сосудами сетчатки и хориоидальными сосудами является менее выраженным, чем в случае с темным глазным дном. Наличие тапетума уменьшает качество изображений ФАГ, тем самым ограничивая способность исследовать аномалии в пределах тапетального глазного дна.
Крупные хориоидальные сосуды и сосуды сетчатки имеют непроницаемые стенки, которые не позволяют молекуле флюоресцеина выходить в перивазальное пространство. В хориокапиллярах имеются фенестрации, и поэтому молекулы флюоресцеина просачиваются из этих сосудов. Вышедший таким образом из сосудов
краситель может дойти до основания мембраны Бруха, но не может попасть в субретинальное пространство, если только не нарушены плотные меж-
клеточные контакты пигментного эпителия.
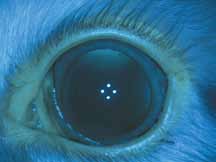
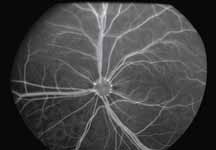
2. Артериальная фаза
Во время этой фазы вены все еще остаются темными, так как флюоресцеин еще не прошел по капиллярному руслу. Необходимо оценить симметричность и равномерность заполнения сосудов.
3. Ранняя венозная фаза
Первым признаком этой фазы является наличие ламинарного пристеночного тока красителя. Ламинарный ток является результатом более быстрого тока крови по центру сосуда и скопления красителя вблизи его стенок. Аrea centralis является аваскулярной зоной. Данная зона на ангиограммах выглядит темной не только из-за отсутствия сосудов, но и из-за высокой концентрации ксантофилла в наружном плексиформном слое.
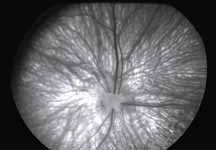
5. Поздняя венозная фаза
В данной фазе ламинарный ток исчезает. Артерии еще можно легко различать. Мембрана Бруха меняет цвет под воздействием красителя, так же как и склера, и фиброзная ткань, встречающаяся при патологии.
6. Фаза рециркуляции
Данная фаза является последней фазой ангиограммы. Большая часть красителя покидает глаз. В эту фазу можно увидеть прокрашивание склеры, а также, в случае тонкого RPE, хориоидальные артерии на темном фоне. Из-за отсутствия реального хориоидального барьера и барьера хориоид-зрительный нерв, зрительный нерв становится прогрессивно флюоресцентным в поздней фазе.
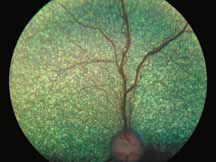
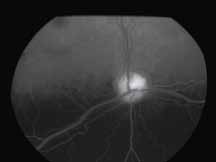
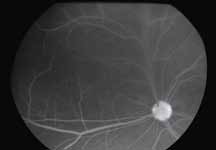
Нормальное прокрашивание
Существует несколько вариаций нормального прокрашивания на ангиограммах в позднюю фазу. Встречается прокрашивание краев диска по причине естественного просачивания из хориокапилляров по краю нерва, а также прокрашивание решетчатой пластинки. У пациентов со слабо выраженной пигментацией в норме можно увидеть прокрашивание склеры с хорошо выраженными крупными хориоидальными сосудами (рис. 8).
Ниже приведена нормальная циркуляция флюоресцеина у человека
(время приблизительное):
• 0 с – инъекция флюоресцеина;
• 9,5 с – задние цилиарные артерии;
• 10 с – хориоидальное заполнение
(«преартериальная фаза»);
• 10–12 с – ретинальная артериаль-
ная фаза;
• 13 с – капиллярная переходная
фаза;
• 14–15 с – ранняя венозная фаза
(«ламинарная стадия», «артериаль-
но-венозная фаза»);
• 16–17 с – венозная фаза;
• 18–20 с – поздняя венозная фаза;
• 5 мин – поздняя фаза рециркуля-
ции.
Алгоритм интерпретации
ангиограмм
Перед проведением ФАГ при помощи фундус-камеры необходимо получить стандартные цветные фото графии глазного дна и детально описать их. Только после этого приступаем к интерпретации ангиограмм.
1. Оценка фотографии в бескрасном свете правого/левого глаза с описанием состояния сосудов и слоя нервных волокон сетчатки, рефлекс
аrea centralis.
2. Определяем, какой глаз на ангиограмме (для удобства и выработки привычки мы всегда начинаем исследования глазного дна с левого глаза, делаем серию снимков левого глаза и далее делаем снимок «в пустоту» (данное фото является разграничителем между фото глаз), далее приступаем к получению фото правого
глаза). Так как портативные камеры не позволяют получать фото двух глаз одновременно, первым исследуется глаз с наибольшими изменениями.
3. Определяем фазу исследования.
4. Описываем заполнение сосудов.
5. Описываем зоны гипер- и/или
гипофлюоресценции (схемы 1, 2).
Диагноз может формулироваться только после полного описания ангиограмм, после чего составляется список дифференциальных диагнозов и по необходимости проводятся дополнительные исследования.
Патологические изменения при ФАГ
Из патологических изменений в ангиограммах можно выявить патологическую флюоресценцию (аутофлюоресценцию, гиперфлюоресценцию, гипофлюоресценцию). Важно помнить,что в аrea centralis имеется область нормальной гипофлюоресценции. Это обусловлено наличием в этом участке аваскулярной зоны и концентрацией
ксантофилла и липофусцина. Алгоритмы оценки гиперфлюоресценции и гипофлюоресценции более подробно будут рассмотрены в одном из следующих выпусков.
Литература
- Wolfe DR. Fluorescein angiography basic science and engineering. Ophthalmology. 1986; 93:1617–1620..
- Morris PF. Fluorescein sodium and indocyanine green: uses and side effects. In: Saine PJ, Tyler ME, eds. Ophthalmic Photography: Retinal Photography, Angiography and Electronic Imaging. 2nd ed. Boston, Butterworth-Heinemann, 2002:137–165.
- Jacobs J. Fluorescein sodium – what is it? J OphthalmicPhotography. 1992; 14: 62.
- Dole RB. Use of fluorescein in the study of underground waters. USGS WaterSupplyPaper. 1906; 160: 73–85.
- Myers B. Prediction of skin sloughs at the time of operation with the use of fluorescein dye. Surgery. 1962; 51:158–162.
- McCaw JB, Myers B, Shanklin KD. The value of fluorescein in predicting the viability of arterialized flaps. PlastReconstrSurg. 1977; 60: 710–719.
- Marfuggi R, Greenspan M. Intraoperative prediction of intestinal viability. SurgGynaeObstet. 1981; 152: 33-35.
- Martonyi CL, Bahn CF, Meyer RF. Clinical Slit Lamp Biomicroscopy and Photo Slit Lamp Biomicrography. AnnArbor, MI, TimeOneInk, Ltd, 1985: 64–67.
- Physicians' Desk Reference for Ophthalmic Medicines. Montvale, Thompson PDR; 2006; 207.
- Palestine AG. Does intravenous fluorescein interfere with clinical laboratory testing J OphthalmicPhotography. 1991; 13: 27–28.
- Bloom JN, Herman DC, Elin RJ, et al. Intravenous fluorescein interference with clinical laboratory tests. Am J Ophthalmol. 1989; 108: 375–379.
- Mattern J, Mayer PR. Excretion of fluorescein into breast milk [letter]. Am J Ophthalmol. 1990; 109: 598.
- AK-FLUOR package insert, rev. 08/05. Akorn, Inc Buffalo Grove, IL. http://www.akorn.com/documents/catalog/package_inserts/17478-254-10.pdf.
- Halperin LS, Olk RJ, Soubrane G, et al. Safety of fluorescein angiography during pregnancy. Am J Ophthalmol. 1990; 109: 563–566.
- Greenberg F, Lewis RA. Safety of fluorescein angiography during pregnancy [letter]. Am J Ophthalmol. 1991; 110: 323–325.
- Berkow JW, Flower RW, Orth DH, Kelley JS. Fluorescein and Indocyanine Green Angiography, 2nd ed. SanFrancisco: AmericanAcademyofOphthalmology. 1997. 7 p.
- Chazan BI, Balodimos MC, Koncz L. Untoward effects of fluorescein retinal angiography in diabetic patients. AnnOphthalmol. 1971; 3: 42.
- Pacirariu RI. Low incidence of side effects following intravenous fluorescein angiography. AnnOphthalmol. 1982; 14: 32–36.
- Butner RW, McPherson AR: Adverse reactions in intravenous fluorescein angiography. AnnOphthalmol. 1983; 15: 1084–1086.
- Marcus DF, Bovino JA, Williams D. Adverse reactions during intravenous fluorescein angiography. ArchOphthalmol. 1984; 102: 825.
- Yannuzzi LA, Rohrer KT, Tindel LJ, et al. Fluorescein angiography complication survey. Ophthalmology. 1986; 93: 611–617.
- Karhunen U, Raitta C, Kala R. Adverse reactions to fluorescein angiography. ActaOphthalmol. 1986; 64: 282–286.
- Kwiterovitch KA, Maguire MG, Murphy RP, et al. Frequency of adverse systemic reactions occurring after fluorescein angiography – results of a prospective study. Ophthalmology. 1991; 98:1139–1142.
- Kwan AS, Barry CJ, McAllister IL, et al. Fluorescein angiography and adverse drug reactions revisited: the Lions Eye experience. ClinExperimentOphthalmol. 2006; 34: 33–38.
- Eutick M. Sodium fluorescein – colourful past, bright future. J OphthalmicPhotography. 2006; 28: 66–70 .
- Ellis PP, Schoenberger M, Rendi MA. Antihistamines as prophylaxis against side reactions to intravenous fluorescein. TransAmOphthalmolSoc. 1980; 78: 190–205.
- Buchanan RT, Levine NS. Blood pressure drop as a result of fluorescein injection. PlastReconstrSurg. 1982; 70: 363–368.
- Merin LM, Lam BL. Case report: fluorescein angiogram during vasovagal syncope. J OphthalmicPhotography. 1994;16: 94–95.
- Gombos GM, Lieberman RM. Seizures associated with fluorescein angiography. AnnOphthalmol. 1989; 21: 89–90.
- Kelly SP, Mcdermott NJ, Saunders DC, et al. Convulsion following fluorescein angiography. Br J Ophthalmol. 1989; 73: 655–656.
- Hess JB, Pacirariu RI. Acute pulmonary edema following intravenous fluorescein angiography. Am J Ophthalmol. 1976; 82: 567–570.
- Deglin SM, Deglin EA, Chung EK. Acute myocardial infarction following fluorescein angiography. Heart Lung. 1977; 6: 505–509.
- Acasco FJ, Tiestos MT, Navales J, et al. Fatal acute myocardial infarction after intravenous fluorescein angiography. Retina. 1993; 13: 238–239.
- Schatz H. Sloughing of skin following fluorescein extravasation. AnnOphthalmol. 1978; 10: 625.
- Elman MJ, Fine SL, Sorenson J, et al. Skin necrosis following fluorescein extravasation. A surveyoftheMaculaSociety. Retina. 1987; 7: 89–93.
- Lipson BK, Yannuzzi LA. Complications of fluorescein injections. IntOphthalmolClin. 1989; 29: 200––205.
- Kelley JS, Kincaid M. Retinal fluorography using oral fluorescein. ArchOphthalmol. 1979; 97: 2331–2332.
- Hara T, Inami M, Hara T. Efficacy and safety of fluorescein angiography with orally administered sodium fluorescein. Am J Ophthalmol. 1998; 126: 560–564.
- Kinsella FP, Mooney, DJ. Anaphylaxis following oral fluorescein angiography. Am J Ophthalmol. 1988; 106: 745–746.
- Gomez-Ulla F, Gutierrez C, Seonae I. Severe anaphylactic reaction to orally administered fluorescein. Am J Ophthalmol. 1991; 112: 94.
41. Шамшинова А.М., Волков В.В. Функциональные методы исследования в офтальмологии. М.: Медицина, 1999.
42. Бойко Э.В., Коскин С.А., Харитонова Н.Н., Шишкин М.М. Методика обследования больного в офтальмологической клинике: учебное пособие. СПб.: ВМедА, 2013.
43. BSAVA Manual of Small Animal Ophthalmology. Simon Petersen – Jones, Sheila Crispin, 2002.
44. Ophthalmology for the Veterinary Practitioner. F.C. Stades, M.Wyman, Michael H. Boevé ,Willy Neumann , Bernhard Spiess,2007.
45. Slatter’s Fundamentals of Veterinary Ophthalmology, Edition 4 ISBN: 978-0-7216- 0561-6 Copyright © 2008, 2001, 1990, 1981 by Saunders, an imprint of Elsevier Inc.
46. Veterinary ophthalmology / edited by Kirk N. Gelatt, Brian C. Gilger, Thomas J. Kern. 5th ed.
47. Иин С. Полный справочник по ветеринарной медицине мелких домашних животных. Пер.санг. М.: ООО «Аквариум-Принт», 2008. 1024 с.: ил.
48. Флюоресцентная ангиография и анализ получаемых результатов: Методическое пособие для врачей-интернов, клинических ординаторов и аспирантов. Черни Э.; ред. Ю.С. Астахов; перевод с англ. П.А. Нечипоренко. СПб.:Изд-во Н-Л, 2012. 32 с.
49. Современный курс ветеринарной медицины Кирка. Пер. с англ. М.:ООО «Аквариум-Принт», 2005. 1376 с.: ил.
50. Дитмар С., ХольцФ.Г. Флюоресцентная ангиография в офтальмологии: атлас; пер. с англ. М.: ГЭОТАР-Медиа, 2011. 224 с.: ил.




Назад в раздел


















