Клинический случай хирургического лечения остеохондромы бедренной кости у кошки с замещением пострезекционного костного дефекта индивидуальным артродезным эндопротезом, изготовленным методом 3D- печати

Автор (ы): С.С. Горшков (gorschkov.vet@gmail.com), Н.В. Уланова (vet.best@mail.ru), В.В. Мануйлова
Организация(и): Ветеринарная клиника «Бэст» (Новосибирск).
Журнал: №3 - 2019
Ключевые слова: мелкие домашние животные, органосохранная операция, остеохондрома, 3D-печать, индивидуальные хирургические позиционные направители
Key words: small pets, organ-sparing surgery, osteochondroma, 3D printing, individual surgical positional guides
Сокращения: НО – новообразование, МХЭ – множественные хрящевые экзостозы, ОРСО – органосохранная операция, КТ – компьютерная томография, 3D (от англ. 3-dimensional – трехмерная модель, 3D-моделирование, 3D-печать, 3D-печать металлом – общее название технологий аддитивного производства металлических изделий; SLM (Selective Laser Melting) – лазерное селективное плавление металлических порошков. FDM (Fused Deposition Modeling) – моделирование методом послойного наплавления. DICOM-файл (DICOM File) – медицинский отраслевой стандарт создания, хранения, передачи и визуализации цифровых медицинских изображений и документов обследованных пациентов. ПХН – позиционный хирургический направитель (син. хирургический направляющий шаблон (гайд); в литературе также упоминается как прецизионный персонифицированный (индивидуальный) направитель (ППН).
Введение
Остеохондромы скелета кошек составляют 20% первичных доброкачественных опухолей костей (Gradner et al. 2008), и они выглядят как очаговые костные массы с трабекулярным рисунком и гладкими краями (Barr 2005; Dernell 2003; Dernell et al. 2005; Doige 1987; Gradner и др. 2008; Mahoney & Lamb 1996; McAllister & Tobin 2005; Pool & Carrig 1972; Ranade & Pacchiana 2011; Tan и др. 2010; Wood, Grant & McKlveen 2002).
По количеству масс они классифицируются как одиночные (одиночная остеохондрома) или множественные (остеохондроматоз или множественные хрящевые экзостозы) и скелетные (осевые и аппендикулярные) или внескелетные, в зависимости от местоположения (Barr 2005; Dernell 2003; Dernell et al. 2005; Doige 1987; Gradner et al. 2008; Johnson & Watson 2005; Levitin et al. 2003; Mahoney & Lamb 1996; McAllister & Tobin 2005; Pool & Carrig 1972; Ranade & Pacchiana 2011; Tan et al. 2010; Wood et al. 2002). Существует также синовиальная форма, которая проявляется в виде множественных суставных минерализованных тел, которые формируются не из самой кости и расположены внутри сустава или бурсы (Barr 2005; Dernell 2003; Dernell et al. 2005; Doige 1987; Gradner et al. 2008 ; Johnson & Watson 2005; Levitin et al. 2003; Mahoney & Lamb 1996; McAllister & Tobin 2005; Pool & Carrig 1972; Ranade & Pacchiana 2011; Tan et al. 2010; Вуд и др. 2002).
Остеохондромы кошек являются не частой патологией и имеется мало данных об этиологии болезни и методах лечения пациентов. Почти 90% кошек с МХЭ лейкоз-положительные (FeLV). У FeLV-позитивных кошек, отмечается значительно быстрое прогрессирование патологии.
В данном сообщении описаны диагностика, лечение и результаты при единичной остеохондроме у кошки.
История болезни
В ветеринарную клинику «Бэст» (г. Новосибирск) 8 декабря 2018 г. поступил пациент кот породы мейн-кун, возраст – 9 лет, вес –7,5 кг. Поводом для обращения была прогрессирующая хромота и визуальное увеличение конечности в объеме в области бедра.
Ортопедический осмотр
При проведении общего клинического и ортопедического осмотра были выявлены: хромота 2-й степени выраженности на правую тазовую конечность (по Innes J; Vet Rec 2003), болезненность при глубокой пальпации и увеличение конечности в объеме в области дистального сегмента правой бедренной кости. Общий осмотр без отклонений, правый подколенный лимфатический узел увеличен в сравнении с интактным слева.
Диагностика
В сторонней клинике было выполнено рентгенографическое исследование (РГИ) пораженной конечности и компьютерная томография (КТ) тазовых конечностей. По данным РГИ и КТ исследования было выявлено очаговое пролиферативное поражение дистального сегмента бедренной кости с вовлечением периартикулярной части коленного сустава и мягких тканей с областью контакта НО с большеберцовой костью.
Повторно было выполнено РГИ пораженной конечности в 2-х взаимно перпендикулярных плоскостях («EXAMION DR 810 Case Solution / Examion® Maxivet FPS (DR 1417)», общий и биохимический анализы крови, УЗИ сердца и брюшной полости и повторное КТ тазовых конечностей (Siemens SOMATOM Emotion ) для оценки пораженного сегмента кости и определения границ резекции (рис. 1).
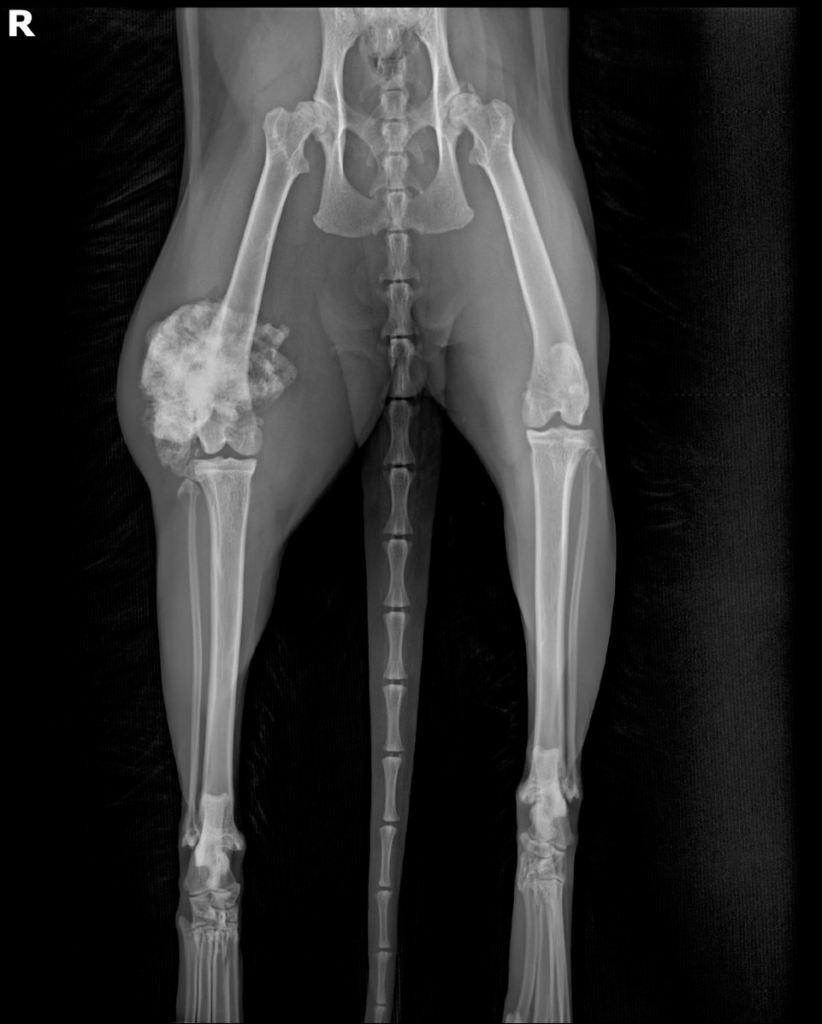
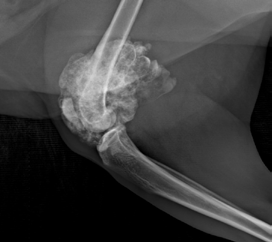
Рис. 1. Рентгенография тазовых конечностей. Очаговое поражение дистального сегмента
правой бедренной кости с выраженной пролиферацией костной ткани и с контактом
большеберцовой кости.
Для исключения отдаленного метастазирования было выполнено КТ онкопоиск (с контрастом). Метастатических поражений не было выявлено. По результатам клинического и биохимического исследования крови, УЗИ сердца, брюшной полости не было выявлено отклонений.
По сравнительной оценке повторного РГИ и КТ исследования с интервалом 1 месяц от первоначальных данных был выявлен экспансивный рост НО (рис. 2).
А 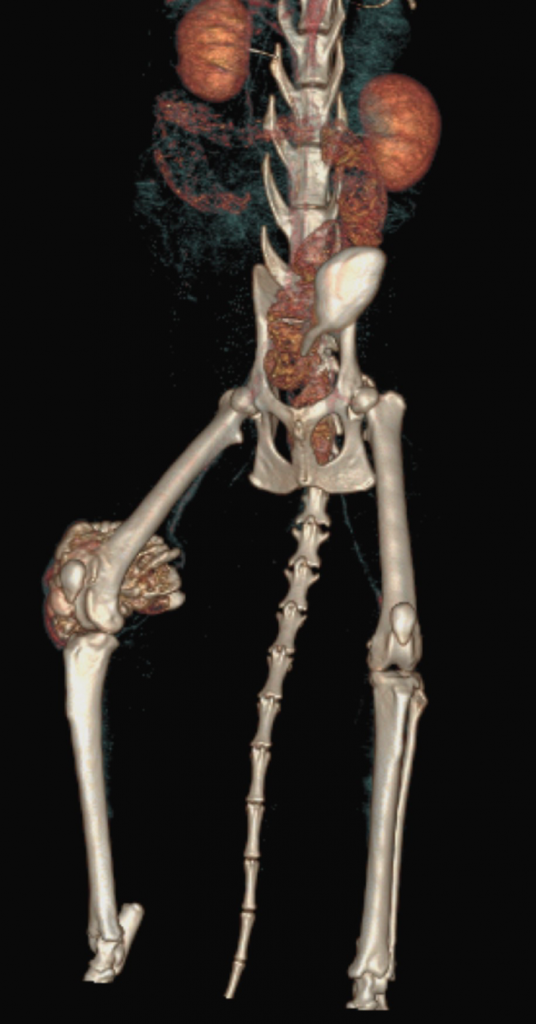 Б
Б 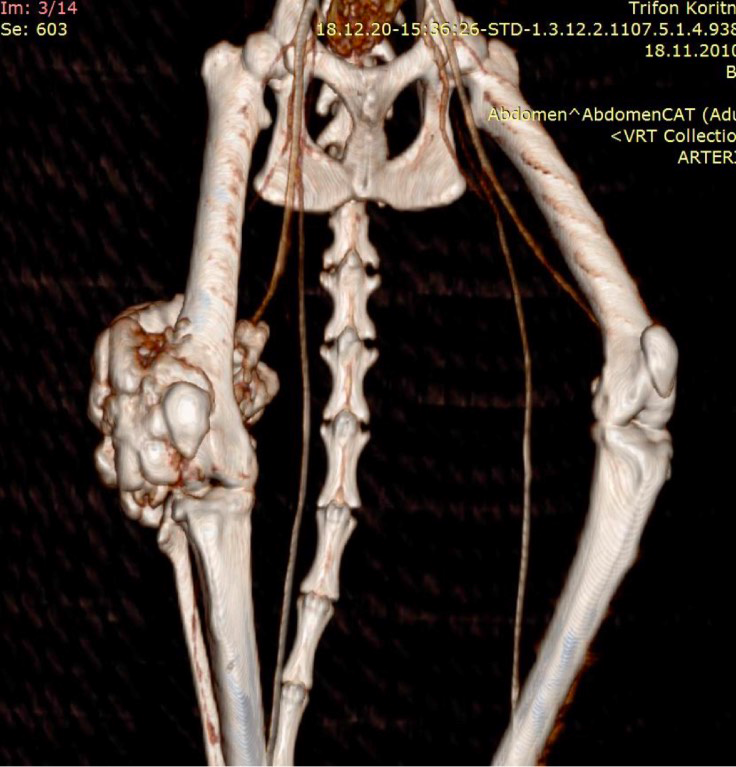
В 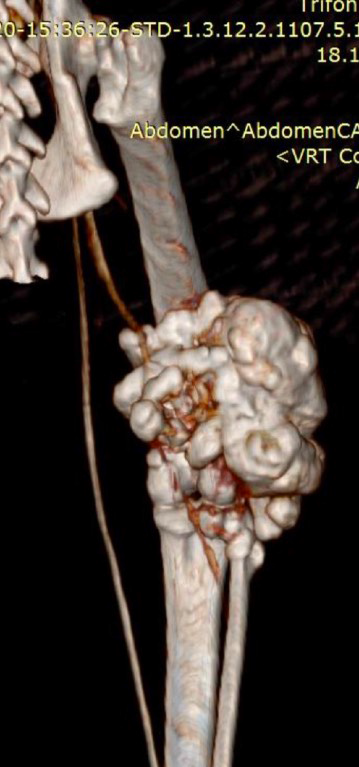 Г
Г 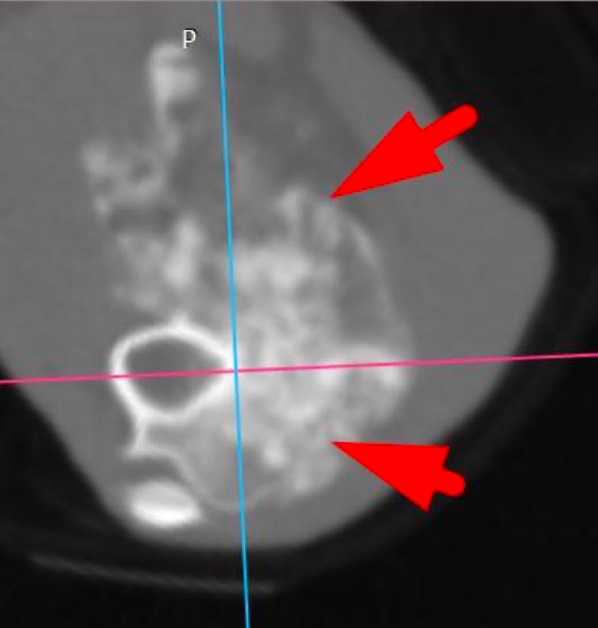
Д 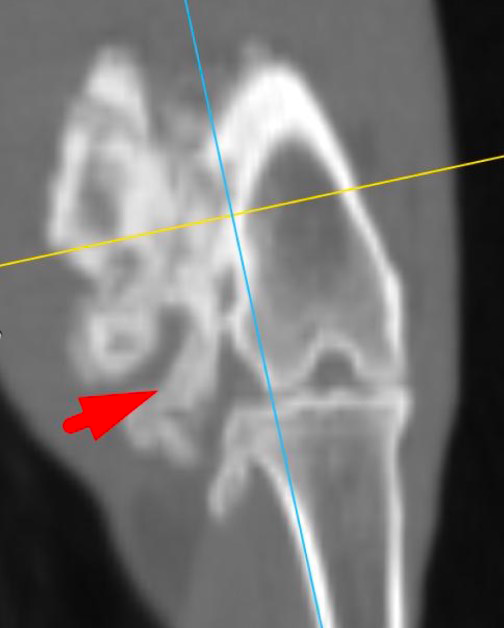
Рис. 2. А – Исходное КТ тазовых конечностей и повторное КТ в динамике через 1 месяц пациента,
описанного выше (Б–Д). Отмечается активный рост НО с выраженной экстрамедуллярной пролиферацией
(отмечено красными стрелками) костной ткани с вовлечением коленного сустава (латеральный мыщелок).
Предварительный диагноз был сформулирован как: хондросаркома, остеохондрома. Дифференциальный диагноз включал: юкстакортикальная саркома (паростальная остеосаркома) бедренной кости.
В связи с ранее выполненным цитологическим исследованием НО путем тонкоигольной биопсии в сторонней клинике и полученного предварительного результата – остеосаркома, было принято решение выполнить широкую сегментарную резекцию с последующим гистологическим исследованием без предварительной трепанобиопсии, что рекомендовано в большинстве случаев.
Предоперационное планирование
Предоперационное планирование (ПП) и определение уровня резекции выполнялось на основании данных КТ. Планирование и разработки 3D-модели эндопротеза и индивидуальных, персонифицированных хирургических направителей (ПХН) (гайдов) для реконструкции пострезекционного костного дефекта (пРКД) использовалось программное обеспечение Polygon Medical Engineering.
Материалы и методы
Используемое оборудование для 3D-печати металлом: аддитивная машина (3D-принтер) Concept Laser M2 cusing с технологией SLM. Материал для изготовления имплантата: титановый сплав (Ti6AI4V), класс металлообработки – 5. Изготовление индивидуальных ПХН для проведения спланированного уровня и объема остеотомии и последующего введения винтов выполняли методом стереолитографиии (3D-печати) из биосовместимого фотополимера Dental SG.
Разработанная конфигурация эндопротеза имеет следующие характеристики: в проксимальной части (бедренный компонент) для крепления к кости эндопротез имеет экстрамедуллярный компонент в виде одной пластины на латеральную часть бедренной кости под уголстабильные винты 2.0 мм и интрамедуллярный компонент в виде пористого ИМ-стержня, фиксируемый в бедренной кости методом «плотной посадки» (press-fit) (рис. 3).
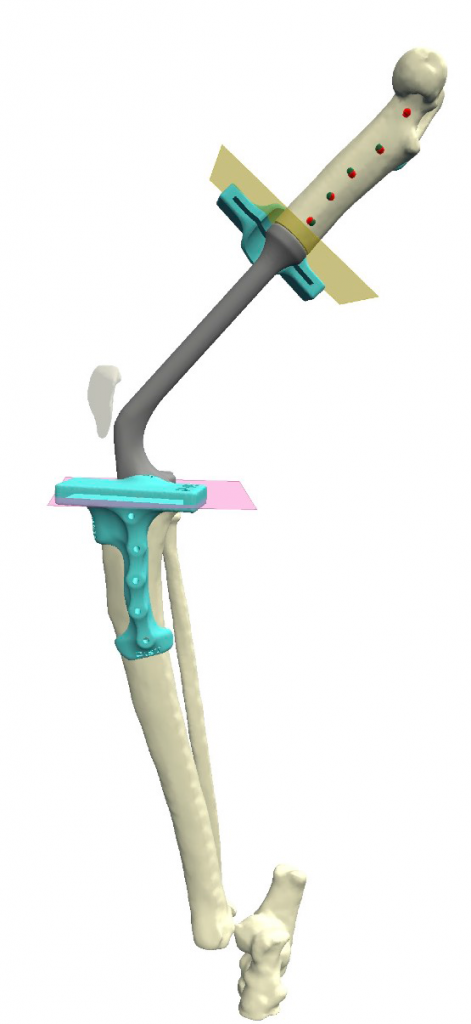
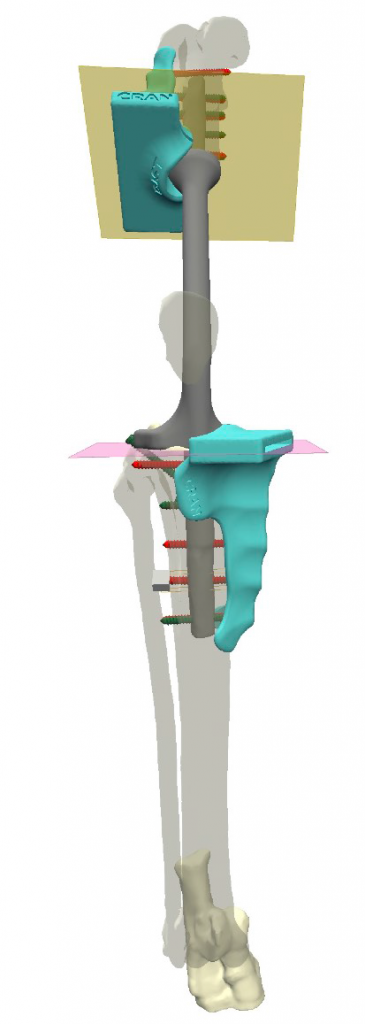
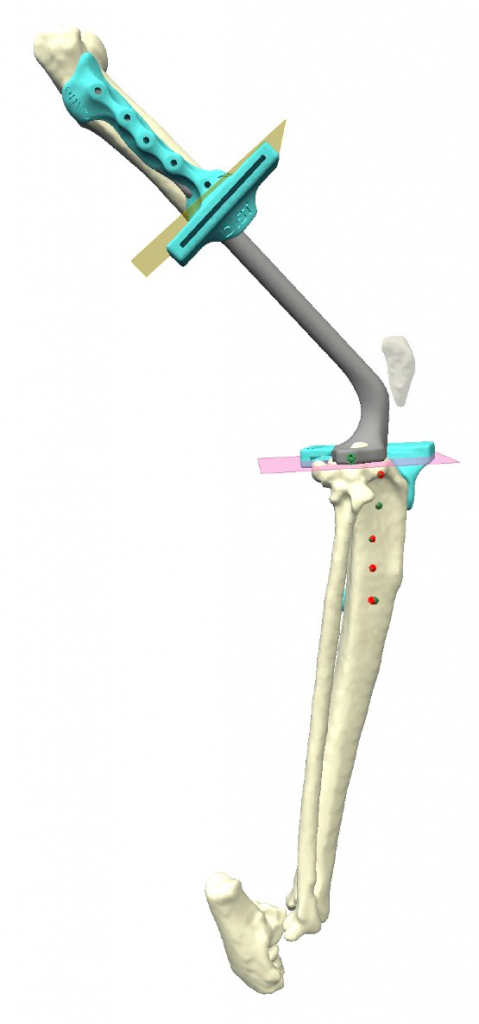
Рис. 3. Планирование органосохранной операции (ОРСО) в программе
планировщике Разработка конфигурации эндопротеза и персонифицированных позиционных хирургических
направителей для остеотомии
Аналогичная конфигурация дистальной части протеза (большеберцовый компонент) была разработата с фиксацией медиально (рис. 4).
А Б
Б  В
В
Рис. 4. Цифровая модель разработанного эндопротеза (ЭП) перед 3D печатью. Конфигурация ЭП включает
бесцементный ИМ пористый стержень в проксимальной части бедра с траснкортикальной фиксацией винтами
2.0 через экстрамедулярную уголстабильную пластину на латеральной стороне. Конфигурация большеберцовой части
ЭП аналогична, но с фиксацией на медиальной поверхности кости. Медиальный (А), краниальный (Б), латеральный
вид (В). Угол артродеза коленного сустава составляет 125° (средние значения для кошек = 115-125°).
Все области контакта эндопротеза с костью на проксимальном и дистальном участке, имеют пористую структуру для достижения остеоинтеграции (рис. 5).
А 
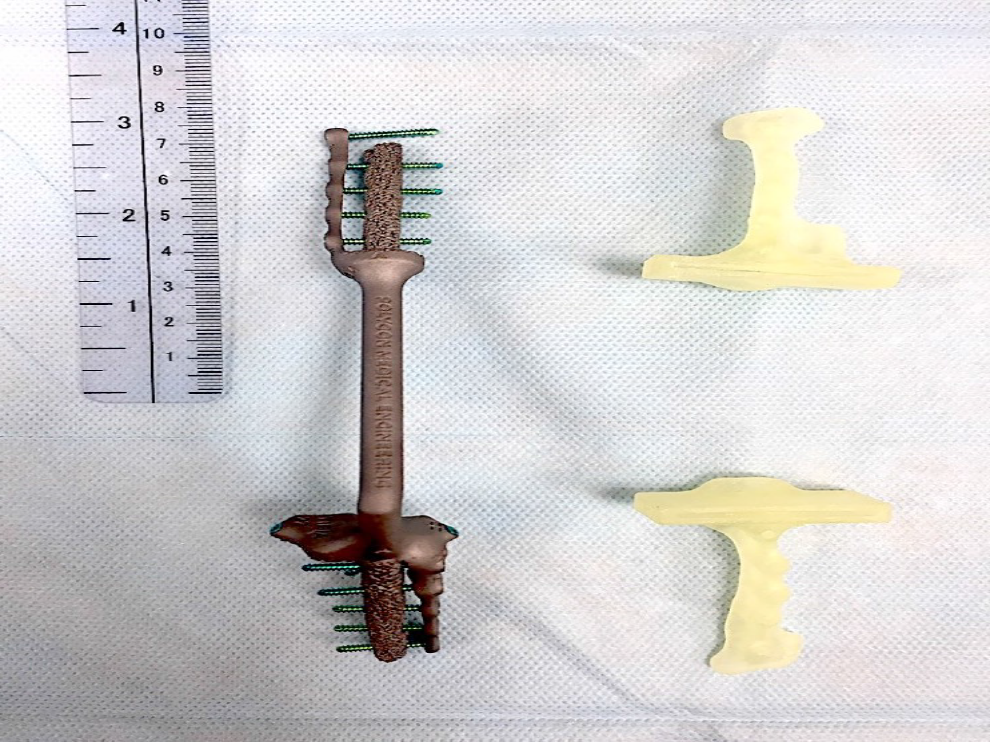
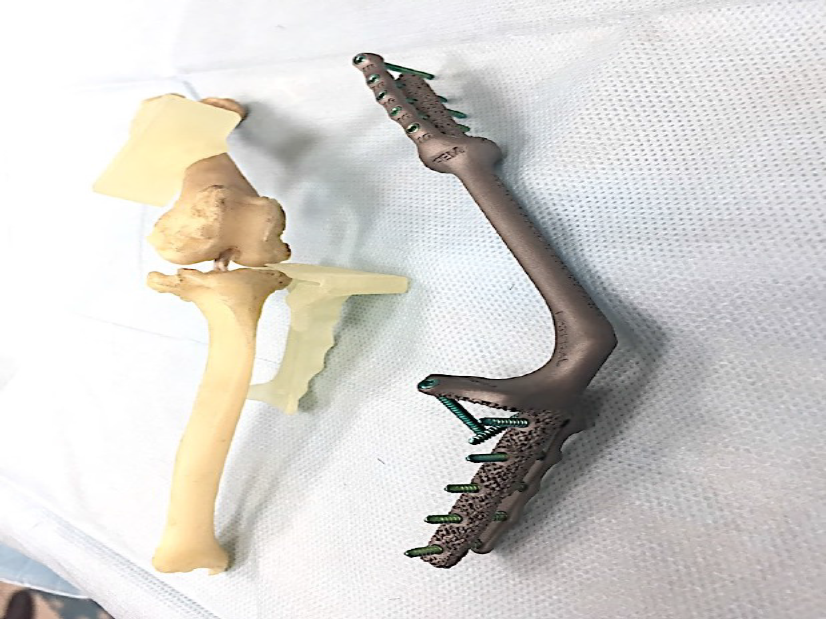
Рис. 5. Внешний вид изготовленного эндопротеза (SLM печать) и ПХН. Пористая
часть в области контакта с костью.
Хирургическая техника
Основные интраоперационные этапы включали: краниолатеральный оперативный доступ с проксимальной границей от большого вертела бедренной кости, продолжаясь каудально и парапателлярно до диафизарного сегмента голени. Далее выполняли установку проксимального и дистального ПХН и последующую остеотомию бедренной кости и голени (рис. 6).
А 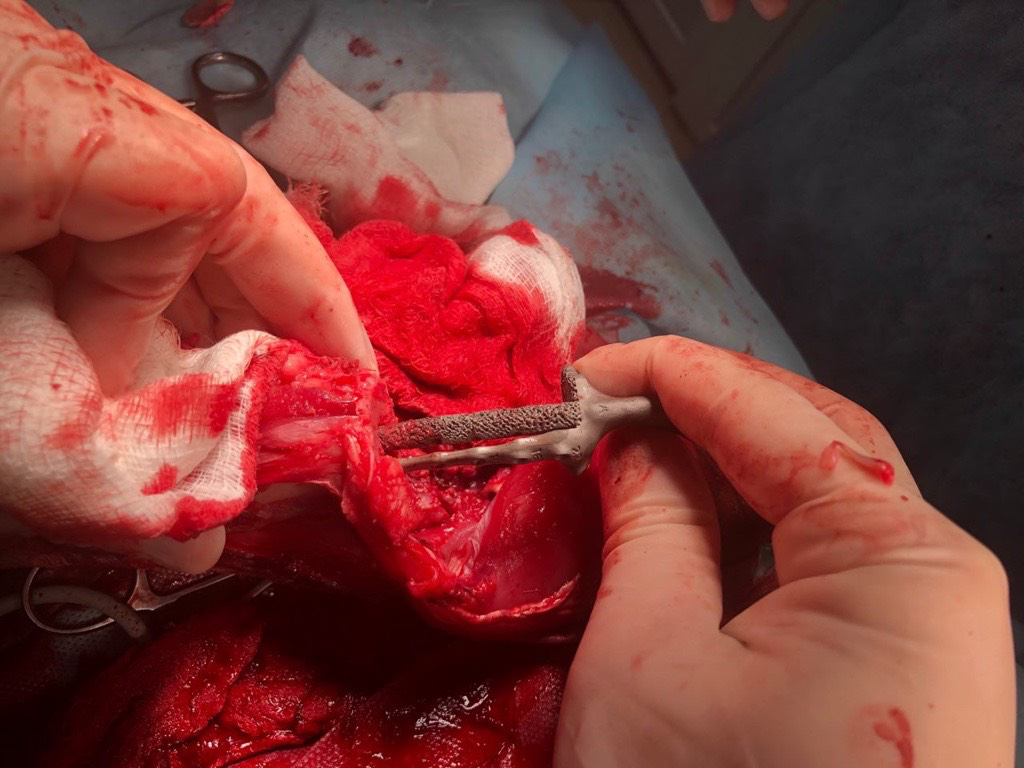
Б 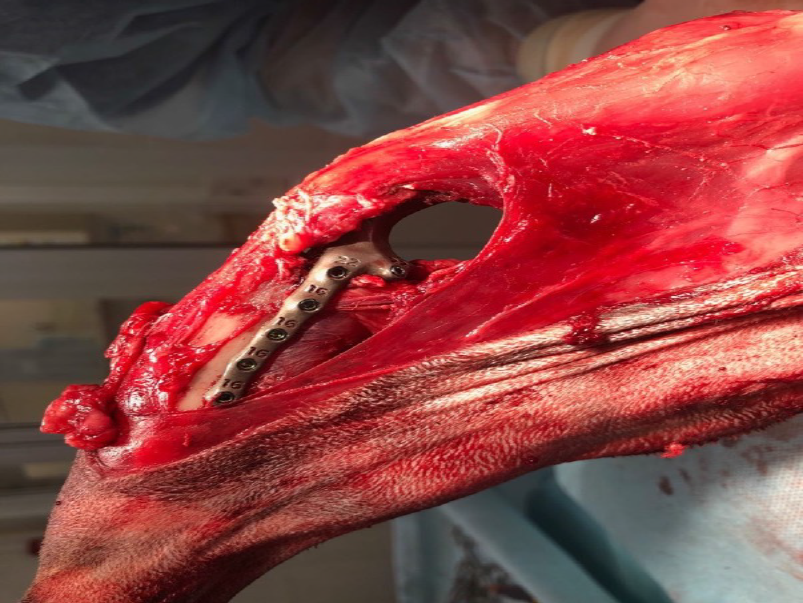
В 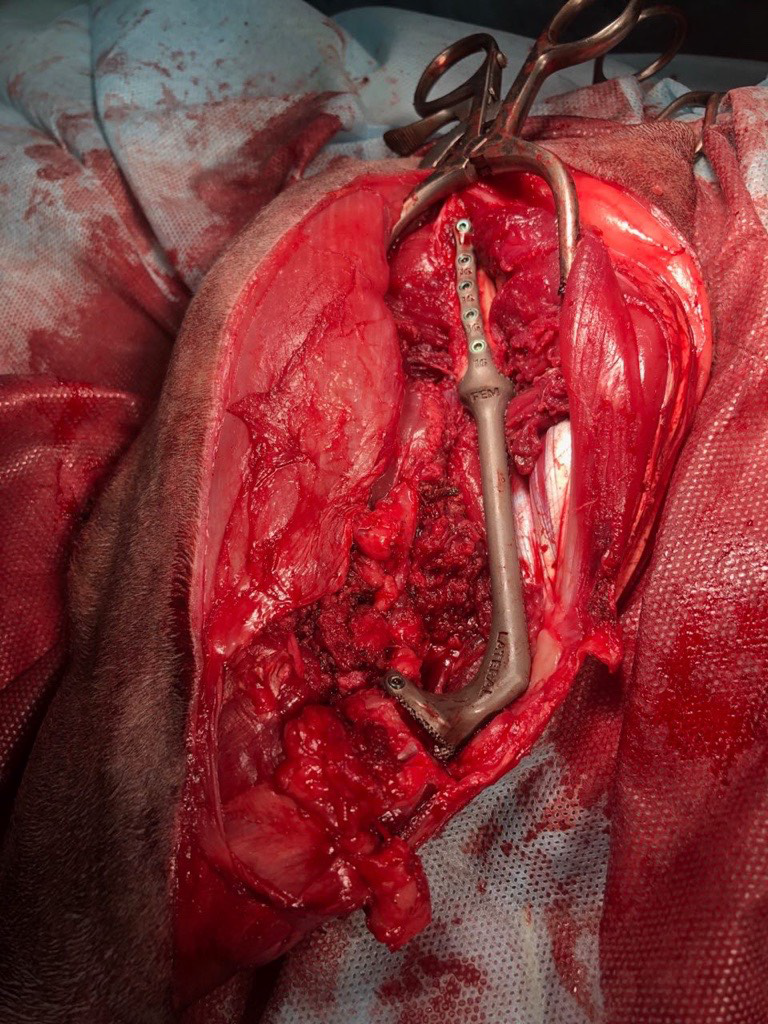
Рис. 6. Основные этапы ОРСО. Выполнено резекция диафизарного сегмента бедренной кости и коленного
сустава единым блоком (тип 2). А - после остеотомии и установки бедренной части эндопротеза (ЭП)
выполняется введение большеберцового компонента ЭП с его последующей фиксацией (Б).
В - Вид перед ушиванием операционной раны.
Затем была выполнена широкая сегментная резекция дистальной части бедренной и проксимальной части большеберцовой костей с удалением коленного сустава в мышечно-фасциальном футляре без вскрытия псевдокапсулы единым блоком (en Block) (экстраартикулярная резекция, тип 2 по Enneking [1].Замещение пострезекционного дефекта выполнено индивидуальным 3D-эндопротезом с формированием полного артродеза коленного сустава с углом 125°.
Следующим этапом выполняли имплантацию и фиксацию 3D-эндопротеза на проксимальном и дистальном сегменте бедра и голени. Операционную рану ушивали простыми узловыми швами адсорбирующим монофиламентным шовным материалом (PDX). Послеоперационно выполняли контрольные рентгенограммы, а также рентгенограммы резецируемого сегмента кости для предварительной оценки границ резекции (рис. 7).
Контрольное КТ тазовых конечностей выполнялось через 1 месяц (рис. 8).
А 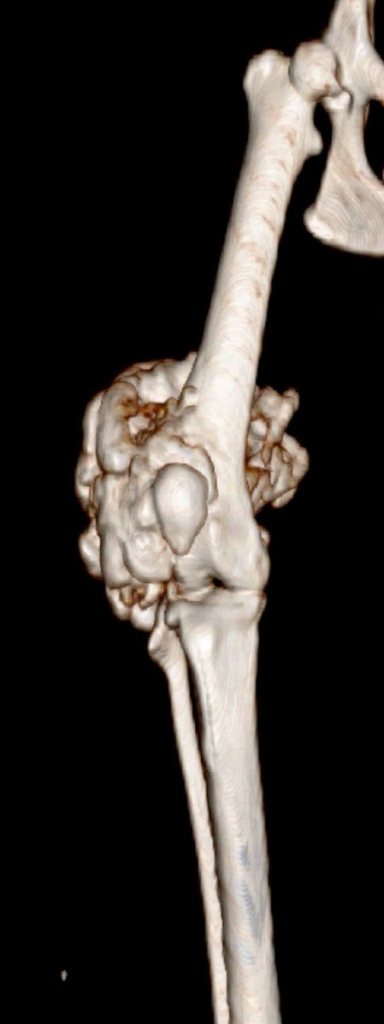 Б
Б 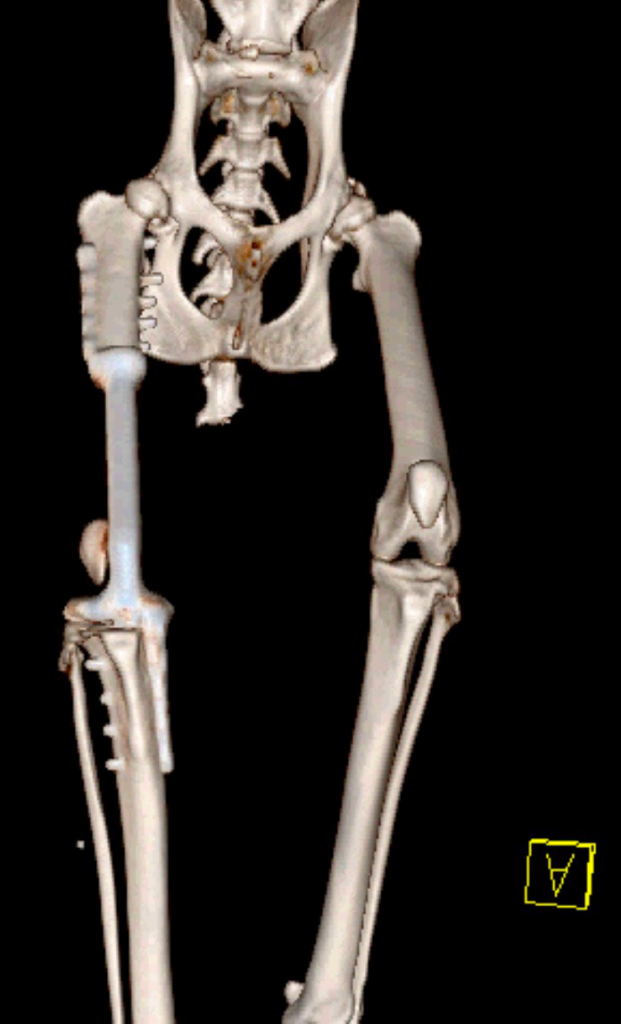
В 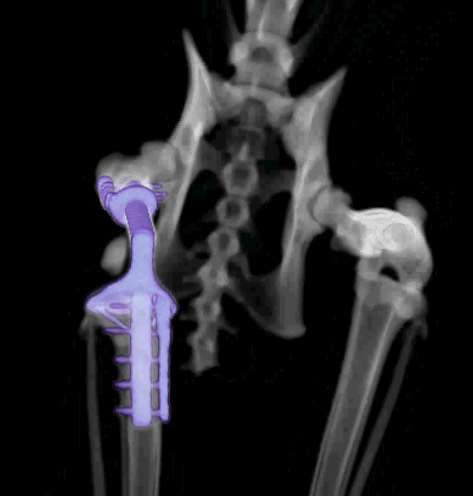 Г
Г 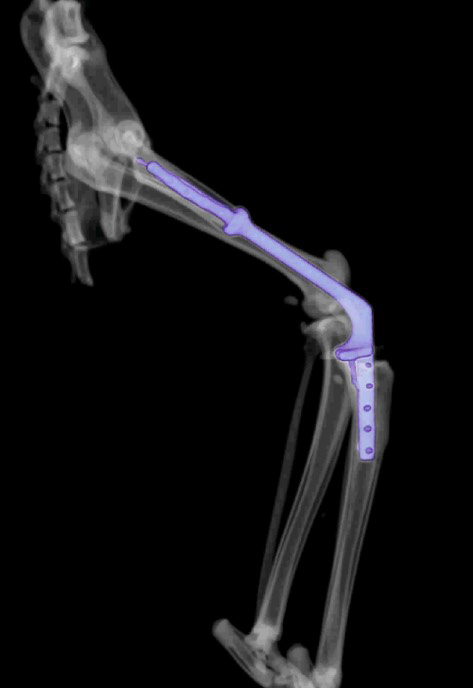
Рис. 8. КТ до (А) и после ОРСО через 1 месяц (Б-Г).
• Соостность (Alignment) – сохранена
• Аппарат фиксации (Apparatus) – 3D эндопротез / несостоятельности, перелома
не выявлено
• Репозиция (Apposition) – без изменений / потери репозиции не отмечено
• Активность (Activity) – резорбции кости не отмечено.
Мофологический диагноз по результатам гистологического исследования – остехондрома (рис. 9).
А 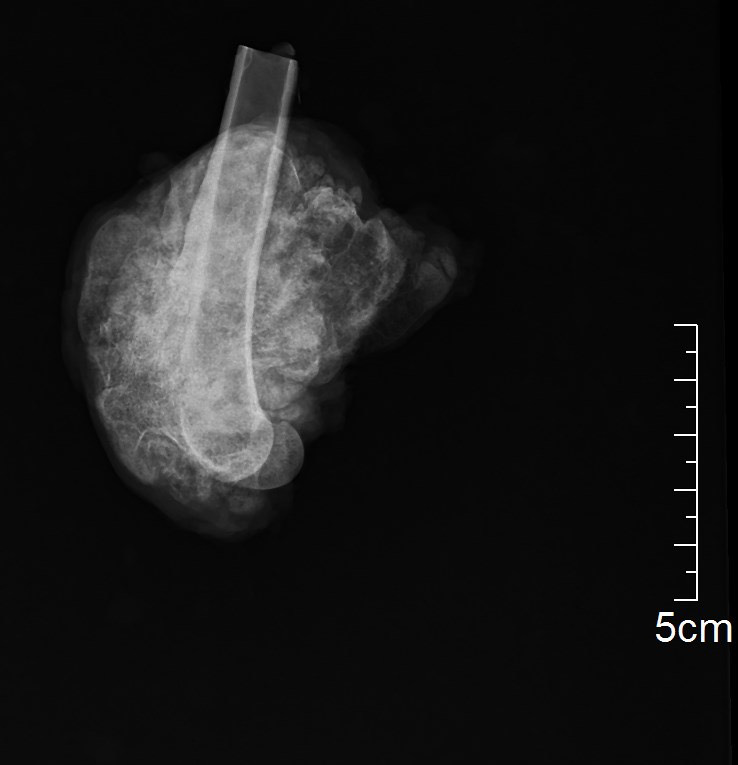
Б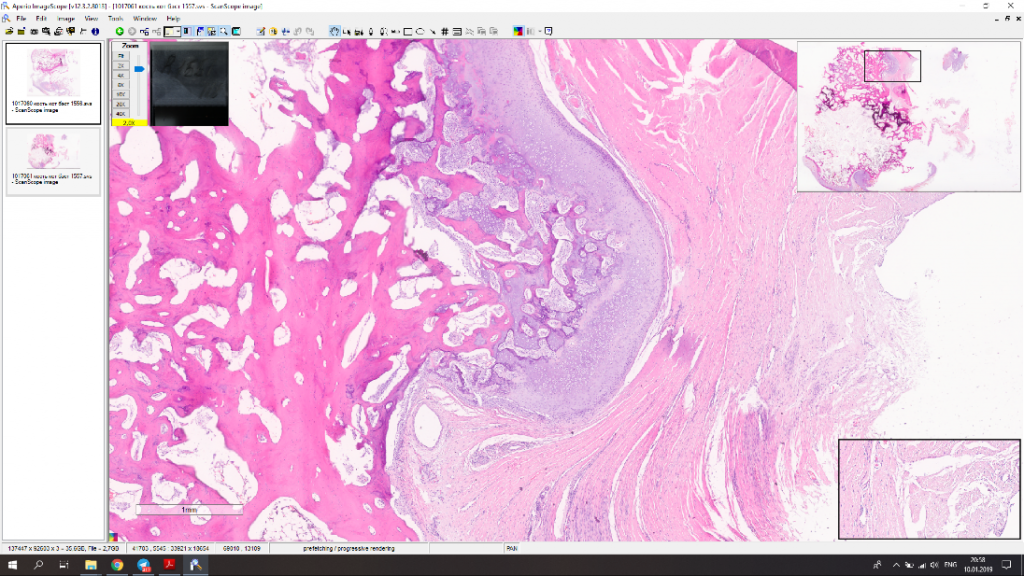
В 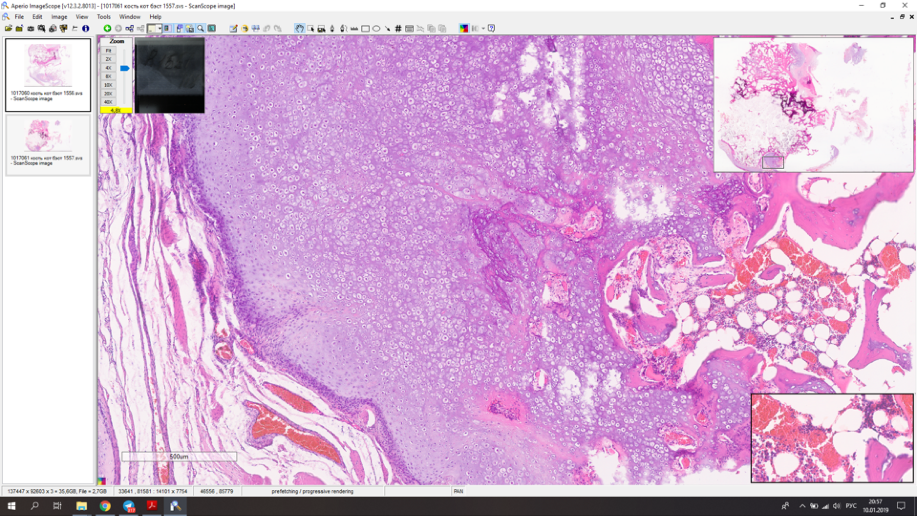
Рис. 9. А – рентгенограмма резицируемого сегмента кости. Б,В – результаты гистологического
исследования. Морфологический диагноз: остеохондрома. Описание. Локализация забора
материала – дистальный эпизиф бедренной кости. В препарате представлены фрагменты
дольчатого образования с размером отдельных узлов до 10-24 мм, состоящим из узелков пролиферации
хорошо минерализованной губчатой кости, с поверхности покрытых гиалиновым хрящом,
подвергающимся последовательной эндохондральной оссификации. Интерстиций кости заполнен
жиром с костным мозгом. Признаки атипии тканевых элементов не выражены.
Послеоперационный период
В послеоперационном периоде осложнений со стороны хирургической раны не было выявлено. Послеоперационная противовоспалительная терапия включала в себя применение препарата робенакоксиб в дозировке 1 мг/кг, 1 раз в день курсом 14 дней. В послеоперационный период на протяжении 14 дней использовали антибактериальные препараты: синулокс (20 мг/кг, 2 р/д) курсом в 21 день.
Результаты
Опорная функция конечности присутствовала с первых суток после оперативного вмешательства (рис. 10).
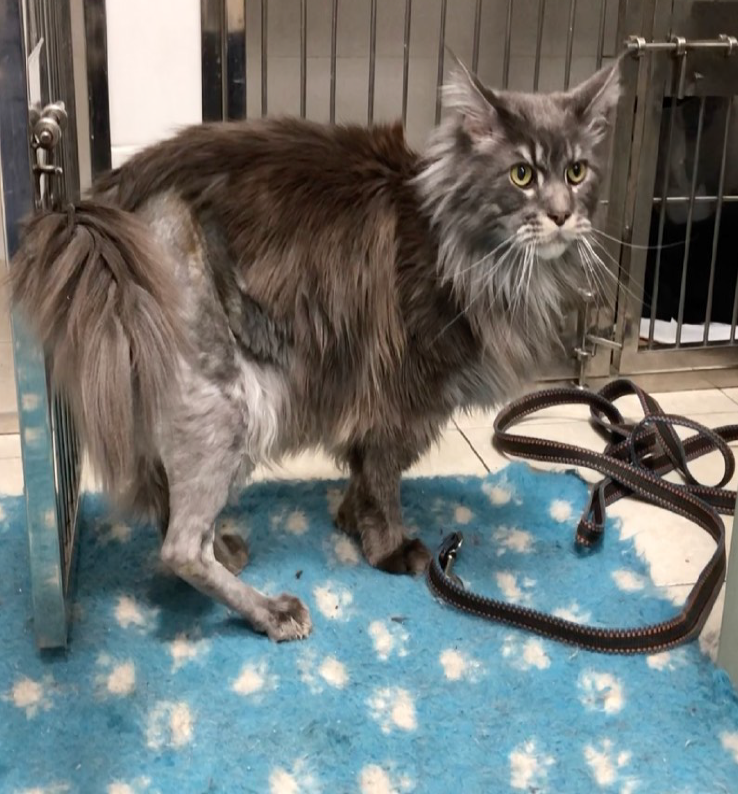


Рис. 10. Внешний вид после ОРСО через 1.5 месяца и через 3 мес.
Отмечается полноценная опороспособность.
Заживление операционной раны произошло по первичному типу натяжения. Отступ от очага поражения ОС после сегментарной резекции составил 4,5 см. Период наблюдения с момента оперативного лечения на момент написания работы (08.08.2019) составляет (8+ мес.). По результатам контрольного РТГ через 5 месяцев несостоятельности эндопротеза выявлено не было (рис. 11).
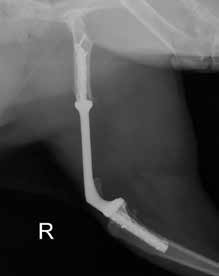
Рис. 11. Рентгенографическая оценка через 8 месяцев:
• Соостность (Alignment) – сохранена
• Аппарат фиксации (Apparatus) – 3D эндопротез / несостоятельности, перелома
не выявлено
• Репозиция (Apposition) – без изменений /
потери репозиции не отмечено
• Активность (Activity) – краевая пролиферация кости на уровне дистального края
диафизарного сегмента бедренной кости (желтая стрелка).
Осложнения
В ранний послеоперационный период была отмечена плохая опорная функция тазовой конечности при ее выносе в виде циркумдукции, что было нивелировано спустя 4 недели путем реабилитации. Данная особенность скорее характерна для адаптационного периода у пациента ввиду создания артродеза коленного сустава. Угол в 120-125° при артродезировании коленного сустава по нашему опыту и по результатам ряда работ кажется наиболее приемлемым для кошек [2].
В послеоперационный период отмечалась временная нейропраксия седалищного нерва в виде волярной флексии, которая была нивелирована спустя 3 недели после курса реабилитации. Данное осложнение является ятрогенным и связано с диссекцией мягкотканного компонента НО в каудальной области бедренной кости (заднебедренная группа мышц) и в подколенной области. В связи с резекцией плато большеберцовой кости и иссечения икроножных мышц, вовлеченных в мягкотканный компонент НО, послеоперационно отмечалась гиперэкстензия заплюсневого сустава. Интраоперационно для нивелирования данного осложнения была выполнена фиксация икроножных мышц к пористой части каудальной поверхности имплантата узловыми монофиламентными швами (полипропилен).
Обсуждение
Первичные опухоли костей составляют 4,9% от всех опухолей у кошек (Dernell 2003; Dernell et al.2005; Doige 1987; Durham, Popovitch & Goldschmidt 2008). Из них 67,0%-90,0% являются злокачественными (Dernell 2003; Dernell et al. 2005; Doige 1987; Durham et al. 2008). Из злокачественных опухолей скелета кошек наиболее распространенной является остеосаркома (70,0% -80,0%) (Dernell 2003; Dernell et al. 2005).
МХЭ возникают в основном у взрослых кошек, средний возраст которых –
3,2 года. Отмечены случаи злокачественного перерождения МХЭ с формированием хондросаркомы или остеосаркомы и с образованием метастазов [5]. У всех кошек при выявлении МХЭ рекомендовано проводить диагностику на лейкоз. Данный пациент по результатам ПЦР-диагностики был отрицательный по вирусу кошачьей лейкемии (FeLV).
Рентгенологически внеcкелетная остеохондрома у кошек неотличима от паростальной (юкстакортикальной) и внескелетной остеосаркомы и внескелетной хондросаркомы. Таким образом, для подтверждения диагноза необходимо гистологическое исследование во всех случаях (Gradner et al. 2008; Tan et al. 2010) (рис. 12).
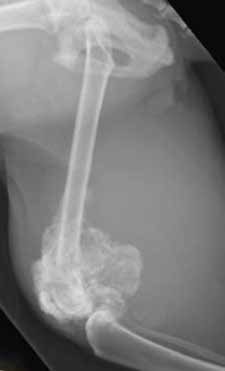
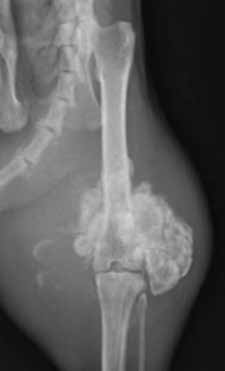
Рис. 12. Рентгенография тазовых конечностей. Кошка, 13 лет с прогрессирующей хромотой
и увеличением конечности в объеме в области коленного сустава Пролиферативное НО
эпифизарного сегмента бедренной кости с вовлечением средней трети диафиза, с очагами
остеолизиса и зонами склероза Гистологический диагноз – хондросаркома. (BSAVA Manual of
Canine and Feline Musculoskeletal Imaging; Kirberger, R.M., McEvoy, F.J.; 2016)
В качестве методов оперативного лечения описаны широкая сегментарная резекция, которая может носить излечивающий характер, тотальная ампутация конечности, паллиативая краевая резекция, так как полное хирургическое иссечение не всегда может быть выполнено, ввиду того что МХЭ имеют тенденцию вовлекать соседние мягкие ткани.
Выводы
Основная цель ОРСО – раннее функциональное восстановление опороспособности пациента. Это достигается путем широкой сегментарной резекции пораженной кости с последующей реконструкцией сегмента и создания стабильной фиксации между сохранными сегментами конечности. Сегментарная резекция была выполнена с использованием «напечатанных» индивидуальных шаблонов (ПХН), что позволяет с точностью до 1 мм выполнить предоперационно спланированную хирургом резекцию НО на требуемом запланированном уровне, а реконструкция пРКД была выполнена индивидуальным 3D-эндопротезом.
Индивидуальные прецизионные хирургические направители
Использование ПХН позволяет сократить время ОРСО, выполнить остеотомию с предельной точностью в пределах заранее спланированной области резекции. Также сформированные отверстия в кости для фиксации ПХН, соответствуют отверстиям в уже изготовленном эндопротезе, что требует лишь однократно выполнить рассверливание отверстий в кости, а затем выполнить введение винтов. Проводить ОРСО, стоит не позднее 10-14 дней с момента выполнения КТ, так как вторичные изменения в случае прогрессирования НО (инвазия) могут изменять структуру кости и мягких тканей и не позволить адекватно расположить как направляющие ПХН, так и сам эндопротез.
Использование индивидуальных 3D-эндопротезов для реконструкции пРКД
Применение технологий 3D-печати обеспечивает их индивидуальность, возможность создания протезов любой формы, сложности и размеров, исходя из требований хирурга под конкретного пациента. Возможность создания пористой структуры титана в местах контакта с костью впоследствии позволяет достигать остеоинтеграции. Данных условий невозможно добиться каким-либо другим способом производства, кроме аддитивных методов. Конфигурация эндопротеза «ИМ-стержень фиксируемый методом «плотной посадки» (press-fit) + блокируемая пластина, позволяет нивелировать основные силы, действующие на область кость-эндопротез, позволяет добиться адекватной аксиальной поддержки, равномерно распределять нагрузку и создать более прочное соединение, чем аналогичные техники, используемые в монорежиме. По результатам биомеханических исследовании, ИМ-стержень обеспечивает большую площадь контакта с костью, приводит с снижению изгибающих нагрузок на винты, что снижает концентрацию нагрузки на них [3,4]. Создание уголстабильных отверстий в эндопротезе позволяет добиваться более жесткой фиксации, особенно у пациентов с тонкими кортикальными слоями кости [4,5,6].
Предоперационное планирование ОРСО на основании данных КТ с использованием программ-планировщиков, а также в тесном сотрудничестве с биоинженерами представляет следующий этап развития онкоортопедии и реконструктивной хирургии, позволяя добиваться предсказуемо запланированных результатов и отказаться от «импровизационной» хирургии, что является наиболее распространенным подходом в ветеринарной медицине сегодня.
Заключение
В последнее время органосохранные операции становятся стандартом при НО аппендикулярного скелета у собак и кошек во всем мире при условиях правильного подбора кандидатов и без ущерба онкологического радикализма. Использование компьютерной 3D-реконструкции позволяет точно спланировать области хирургической резекции, объем резецируемого фрагмента с последующим его замещением.
Данный подход и метология планирования ОРСО и изготовления индивидуальных протезов может быть использовано при чрескожном остеоинтегрируемом протезировании конечностей у животных после перенесенной ампутации, а также при замещении более значительных дефектах костей у животных (рис. 13, 14).
А  Б
Б 
В 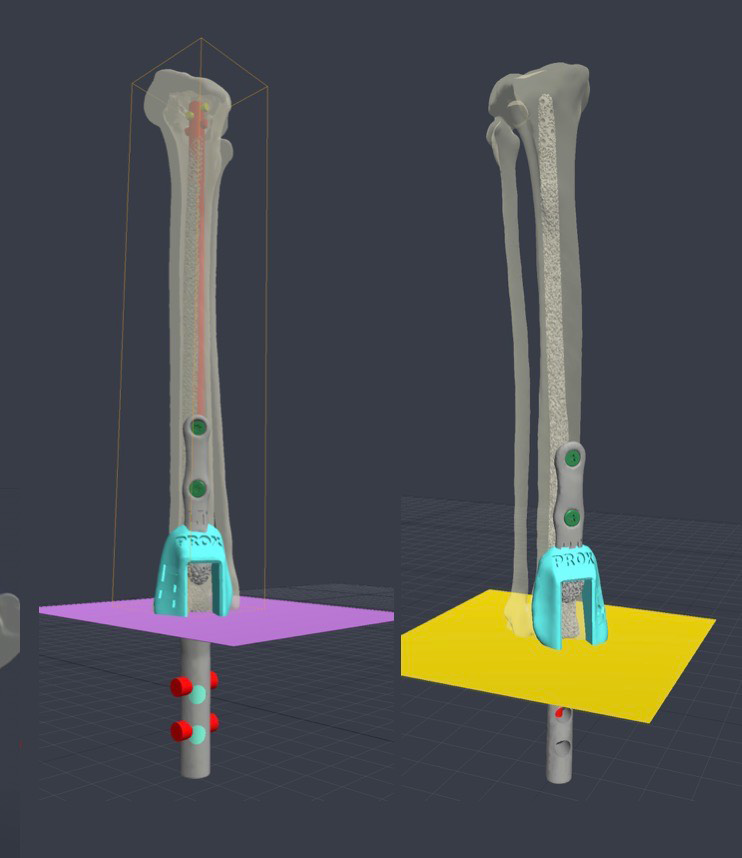
., Д 
Рис. 13. Клинический случай протезирование 4-х лап у кошки. А - Внешний вид пациента
после перенесенной ампутации на уровне предплечья и заплюсневых суставов по поводу
холодовой травмы (отморожение). Б, В - разработка индивидуальных чрескожных
остеоинтегрируемых протезов (ЧОИП) модель SerGoFIX тип 4 для грудных и тип 3 для
тазовых конечностей. Г, Д – Изготовленные ЧОИП методом 3D печати (SLM) конфигурации
тип 3 после постобработки и нанесения кальцийфосфатного покрытия
Использование адитивных технологий с созданием персонифицированных ПХН и эндопротезов позволяет индивидуально и одномоментно заместить костные дефекты любой формы, сложности и размеров, возникающие после удаления опухоли и упростить технику операции, сократив время оперативного вмешательства. Использование 3D-печати металлом для замещения обширных костных дефектов после перенесенной ОРСО у животных на сегодняшний день имеет актуальность и огромный потенциал, даже больший, чем в гуманной медицине в связи с широкой породной вариабельностью анатомии аппендикулярного скелета у собак (рис.15).
А  Б
Б  В
В 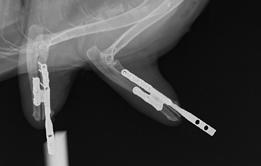 Г
Г 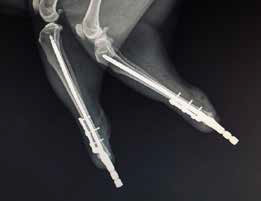
Д  Е
Е 

Рис. 14. А, Б, Д, Е – Внешний вид пациента после ЧОП. Восстановление опороспособности на 4 конечности. В, Г – Послеоперационные
рентгенограммы грудных и тазовых конечностей после ЧОП. Планирование, лечение и опороспособность пациента представлена
в видеоролике по ссылке (QR код).
Благодарности
Отдельное спасибо коллегам, участвующим в лечении пациента и ответственным за его последующего восстановление: Коритняк Маргарите Васильевне, Фердман Наталье Анатольевне, Сакулиной Светлане Леонидовне, всему коллективу Polygon Medical Engineering.
А 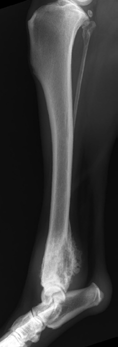 Б
Б 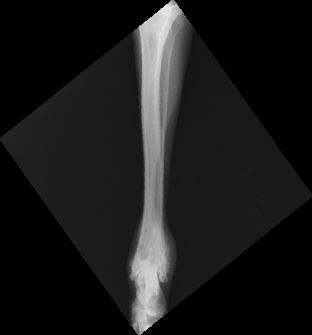 В
В  Г
Г 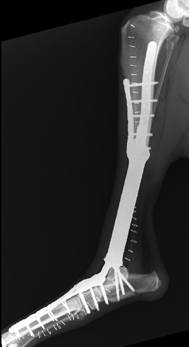 Д
Д 
Рис. 15. А,Б – Остеолитическое поражение дистального сегмента большеберцовой кости у собаки породы Волкодав,
вес 65 кг. В – разработка индивидуального 3D эндопротеза для замещения пострезекционного костного дефекта.
Г, Д – Выполнена органосохранная хирургия с имплантацией артродезного эндопротеза изготовленного методом
3D печати (технология SLM).
Послеоперационная рентгенографическая оценка: Соостность (Alignment) – не нарушена / артродез заплюсневого
сустава с углом 135 град. Аппарат фиксации (Apparatus) – 3D эндопротез Репозиция (Apposition) – открытая,
прямая Активность (Activity) – Опора сохранена

Литература
1. The staging and surgery of musculoskeletal neoplasms. Enneking, WF., Wolf, RE,. 1996 г., OrthopClin N Am 1996;27(3):473-81.).
2. Stifle arthrodesis in two cats. Belch, A., Fitzpatrick, N. и Farrell, M. 2012 г., Vet Comp Orthop Traumatol, Т. 5.
3. Novel Endoprosthesis for Limb Sparing of Canine Distal Radius Osteosarcoma Patients: A Modular Approach. Shetye, S., Ryan,S., Ehrhart, N., Puttlitz, C. Colorado State University : б.н., 2011. DOI: 10.1115/SBC2011-53164.
4. Novel modular limb salvage endoprostheses for treatment of primary appendicular tumors in dogs: short-term outcome. Fitzpatrick, J. Meswania, G. Blunn. Bologna (Italy) : WVOC 2010, 15th - 18th September, 568 N, 2010.
5. Cortical allograft and endoprosthesis for limb-sparing surgery in dogs with distal radial osteosarcoma: a prospective clinical comparison of two different limb-sparing techniques. . Liptak JM, Dernell WS, Ehrhart N, et al. 2006 г., Vet Surg 2006;35:518–533.
6. D. Griffon, A,Hamaide. Complications in Small Animal Surgery . [ред.] ISBN: 978-0-470-95962-6. б.м. : Wiley-Blackwell , Jan 2016.
7. Veterinary Society of Surgical Oncology, 2015.
8. Transplantation of Ipsilateral Canine Ulna as a Vascularized Bone Graft for treatment of distal radial osteosarcoma . Zlatinov, V. 2018. February 13, 2018 .
9. Outcomes of Limb-Sparing Surgery Using Two Generations of Metal Endoprosthesis in 45 Dogs With Distal Radial Osteosarcoma. A Veterinary Society of Surgical Oncology Retrospective Study . Mitchell, K.E., Boston, S.E., Kung, М, Dry, S., Straw, R.C. 2015 г., Veterinary Surgery 45 (2016) 36–43 .
10. Серомы как осложнение хирургического лечения послеоперационных грыж передней брюшной стенки с использованием сетчатых имплантов: современное состояние проблемы. Деговцов, Е.Н., Колядко, П.В. 2018 г., Новости хирургии Том 26 * № 1 * 2018. doi: 10.18484/2305-0047.2018.1.96.
11. Lumachi, F. Seroma prevention following axillary dissection in patients with breast cancer by using ultrasound scissors: a prospective clinical study. Lumachi, A.A. Brandes, P. Burelli et al. 2004 г., Eur. J. Surg. Oncol. — 2004. — 30. — P. 526-30.
12. Клинический случай лечения длительной лимфорреи, возникшей после радикальной мастэктомии. Ивашков, В.Ю. Соболевский, В.А. 2015 г., Поволжский онкологический вестник.
13. Методология выполнения органосохраняющих операций в комплексном лечении опухолей костей конечностей у собак и кошек. П.Г.Дюльгер, С.А.Ягников, Ф.А.Любоев, О.А.Кулешова, М.Д.Валюс, Я.А.Кулешова, Т.А.Леонова. : б.н., 2012 г., Российский ветеринарный журнал, No 3/2012.
14. Хирургическое лечение пациентов с опухолями длинных трубчатых костей верхних конечностей с использованием индивидуальных имплантатов из костнозамещающего материала, созданных по технологиям 3D-печати . Н.Н. Карякин, Р.О. Горбатов, А.Е. Новиков, Р.М. Нифтуллаев. б.м. : Том 23, No 3, 2017 г., 2017 г., Журнал клинической и экспериментальной ортопедии им. Г.А. Илизарова.
15. Биомеханические параметры имплантатов при замещении обширных дефектов кости у собак . Дюльгер, П.Г. Ягников, С.А. Гаврюшенко, Н.С. Фомин, Л.В. Кулешова, О.А. Арифуллина Д.В. 2012 г., РВЖ • МДЖ • No 5/2012 .
16. Компьютерная технология изготовления медицинских имплантатов методом послойного лазерного спекания. М.М. Тверской, Л.Н. Петрова, А.С. Аладин, Е.Ю. Сулацкая, А.С. Жаринова. Вестник ЮУрГУ, No 23, 2012.
17. Трофимцов, Д., Вилковысский, И., Аверин, М. и др. Онкология мелких домашних животных. Учебное пособие . б.м. : Издательство: Научная библиотека, 2017.
18. Outcomes of Limb-Sparing Surgery Using Two Generations of Metal Endoprosthesis in 45 Dogs With Distal Radial Osteosarcoma. A Veterinary Society of Surgical Oncology Retrospective Study. Katherine E. Mitchell, Sarah E. Boston, Marvin Kung, Sarah Dry, Rod C. Straw, Nicole P. Ehrhart, and Stewart D. Ryan. 2016 г., Veterinary Surgery 45 (2016) 36–43.
19. Tobias, K., Johnston, A. Veterinary surgery: small animal; Volume Set 2. . б.м. : by Saunders, an imprint of Elsevier Inc, 2012 .
20. Kudnig, S.T., Séguin, B. Veterinary surgical oncology. 2015.

Назад в раздел

















