Фармакокинетика флураланера у собак после однократного перорального или внутривенного введения

Еще фото
Автор (ы): Susanne Kilp, Diana Ramirez, Mark J. Allan, Rainer K.A. Roepke, Martin C. Nuernberger
Журнал: №1 - 2015
На правах рекламы
Ключевые слова: флураланер, фармакокинетика, собака, пероральный, внутривенный
Аннотация
Общие сведения. Флураланер – новый системный инсектицид и акарицид. Цель настоящих исследований заключалась в изучении фармакокинетических свойств флураланера у собак породы бигль после однократного перорального или внутривенного (в/в) введения.
Методы. После перорального введения 24 собакам породы бигль 12,5, 25 или 50 мг флураланера/кг массы тела (МТ) в составе жевательных таблеток или в/в введения 12,5 мг флураланера/кг МТ в виде раствора для в/в инъекций в течение 112 дней производился сбор образцов плазмы крови. Концентрация флураланера в плазме измерялась с помощью ВЭЖХ-МС/МС. Фармакокинетические параметры рассчитывались на основе некомпартментного подхода.
Результаты. После перорального введения максимальная концентрация (Смах) достигалась в среднем через 1 день. Количественное определение флураланера в плазме было возможно вплоть до 112 дней после однократного перорального или в/в введения. Кажущееся время полувыведения флураланера составляло 12-15 дней, а среднее время удержания – 15-20 дней. Кажущийся объем распределения флураланера был равен 3,1 л/кг, а клиренс – 0,14 л/кг/сут.
Выводы. Флураланер демонстрирует хорошее всасывание после однократного перорального введения и характеризуется длительным временем полувыведения, длительным временем удержания, относительно высоким кажущимся объемом распределения и низким клиренсом. Эти фармакокинетические характеристики позволяют объяснить значительную продолжительность действия флураланера на блох и клещей после однократного перорального введения собакам.
Общие сведения
Флураланер – новый системный инсектицид и акарицид, выпускающийся в виде жевательной таблетки для перорального введения и предназначенный для применения с интервалом в 12 недель в целях эффективного и долговременного уничтожения блох и клещей нескольких видов у собак [1, 2].
Флураланер принадлежит к новому классу химических веществ, существенной особенностью которых является наличие изоксазолиновой структуры [2, 3]. Его молекулярная масса составляет 556,29, а логарифм Ров (коэффициент распределения в системе октанол/ вода) – 5,35; данное вещество прочно связывается с белками плазмы.
Флураланер – мощный блокатор лигандзависимых хлоридных каналов (ГАМК- и L-глутаматзависимых хлоридных каналов) в нейронах, обладающий значительной селективностью в отношении нейронов членистоногих в сравнении с нейронами млекопитающих [2, 3]. Исследования in vivo продемонстрировали, что после однократного перорального введения собакам флураланер в течение 12 недель проявляет долговременную пестицидную активность в отношении блох и клещей [1]. Флураланер – инновационный, высокоэффективный препарат длительного действия для лечения собак.
Методы
Для перорального введения использовались жевательные таблетки, содержащие 13,64 масс. % флураланера. Исследуемый материал для внутривенного введения использовался в виде раствора флураланера концентрацией 2,5 мг/мл в полиэтиленгликольном растворителе, содержащем 10 об. % воды для инъекций.
Здоровые самцы и самки собак породы бигль содержались в загонах в помещении на полу с защитным покрытием; содержание было индивидуальным до 5-6 недель после введения флураланера (перорального или в/в) для недопущения перекрестного заражения животных. После этого собаки содержались в группах по три животных одного пола и из одной группы. Микроклимат контролировался постоянно: температура поддерживалась в пределах 15-21°С, относительная влажность – 40-70%, кратность воздухообмена – 10-20/ч, с чередованием 12-часовых периодов освещения люминесцентными лампами и 12-часовых периодов темноты. Собак кормили один раз в день утром стандартным кормом для собак и обеспечивали свободный доступ к воде. В день введения флураланера собаки получали половину суточного рациона пищи незадолго до введения препарата, а оставшуюся половину – непосредственно после введения, так как прием содержащих флураланер жевательных таблеток с пищей увеличивает биодоступность активного компонента [4].
Для определения скорости и степени системного воздействия после перорального применения, а также пропорциональности экспозиции полученной перорально дозе, было проведено исследование в параллельных группах с участием трех групп животных. Собаки получили 12,5, 25 или 50 мг (целевая доза) флураланера/кг МТ перорально, причем средняя доза (25 мг/кг МТ) была рассчитана на основе минимальной рекомендованной дозы препарата [1]. Дополнительные фармакокинетические параметры, в частности общий клиренс и объем распределения, определялись в отдельном исследовании на шести собаках породы бигль, получавших 12,5 мг флураланера/кг МТ путем медленной в/в инфузии. Все дозировки в последующих разделах выражены в мг флураланера на кг МТ.
В обоих исследованиях собаки были рандомизированы по группам в зависимости от пола (по три собаки каждого пола в каждой группе) и разделены по весовым категориям, чтобы обеспечить сбалансированное распределение. Оба исследования проводились согласно принципам Надлежащей лабораторной практики [5]. Работа с животными велась в соответствии с действующим национальным законодательством и была утверждена Комитетом по этике экспериментов на животных Harlan Laboratories S.A.
Доза для перорального введения определялась индивидуально исходя из массы тела животного и номинального содержания флураланера в таблетках. Собаки получали либо единичные целые таблетки флураланера, содержавшие 112,5 мг, 250 мг или 500 мг действующего вещества, либо комбинации таблеток, составленные таким образом, чтобы получить дозу, близкую к рассчитанной целевой дозе. Для упрощения перорального введения рассчитанная целевая доза помещалась на корень языка собаки. Объем препарата для внутривенного введения определялся индивидуально исходя из массы тела животного. Препарат вводился путем инфузии с постоянной скоростью в течение пяти минут с помощью автоматической инъекционной системы (KDS Model 200, KD Scientific Inc., Holliston, США). Часовая скорость введения была приблизительно в 12 раз выше соответствующего объема препарата, что позволило обеспечить полноту введения в течение пяти минут.
Образцы крови отбирались из яремной вены в пробирки с цитратом натрия до введения препарата, через 2, 4 и 8 часов, а затем через 1, 2, 3, 4, 7, 14, 21, 28, 35, 42, 49, 56, 63, 70, 77, 84, 91, 98, 105 и 112 дней после перорального введения, а также через 15 мин., 2, 4 и 8 ч., а затем через 1, 2, 3, 4, 7, 14, 21, 28, 35, 49, 63, 77, 91 и 112 дней после в/в введения. Плазма выделялась путем центрифугирования и хранилась в замороженном виде в стерильных пластиковых флаконах до момента анализа. Тщательное наблюдение за собаками велось в течение 1 ч. после применения препарата, а затем ежедневно один раз в день.
Образцы плазмы были получены путем осаждения белка ацетонитрилом и разбавлены 0,1% муравьиной кислотой. Полученный раствор подвергали количественному анализу с помощью системы автоматической твердофазной экстракции, совмещенной с жидкостным хроматографом с масс-спектрометрическим детектором (ТФЭ-ВЭЖХ-МС/МС). Диапазон линейности метода при определении флураланера составлял от 10,0 до 2500 нг/мл, а предел количественного определения (ПКО) – 10,0 нг/мл. Фармакокинетические параметры флураланера рассчитывались с помощью неком-партментного подхода с применением прошедшего валидацию ПО WinNonlin® Professional Version 5.3 (Pharsight Corporation, Калифорния, США). Пиковая концентрация в плазме (Сmах) и время достижения пиковой концентрации (tmax) являлись наблюдаемыми величинами. Время полувыведения (t1/2) рассчитывалось с помощью линейной регрессии по угловому коэффициенту конечного сегмента графика временной зависимости концентрации в плазме в полулогарифмических координатах. Площадь под графиком зависимости концентрации от времени (AUC) от начального момента времени до последней измеренной концентрации (AUC(0®t)) рассчитывалась с помощью линейного метода трапеций. Экстраполированная AUC от начального момента времени до бесконечности (AUC(0®∞)) определяли как AUC(0®t) + Ct/ʎz, где Ct – концентрация в плазме в момент t, а ʎz – константа скорости первого порядка для конечного (лог-линейного) участка графика. Кажущийся объем распределения (ʎz) после в/в введения рассчитывался для конечного участка как доза / ʎz X AUC. Общий клиренс (Cl) после в/в введения рассчитывался как доза/AUC. Биодоступность (F%) при пероральном введении рассчитывалась на основе средних AUC (0®∞) как (AUC (0®∞) перорально/ AUC (0®∞) в/в) x (доза в/в / доза перорально ) x 100. Среднее время удержания (СВУ), экстраполированное на бесконечность, рассчитывалось как отношение AUMC/AUC, где AUMC – площадь под кривой первого момента. Пропорциональность дозе проверялась для параметров экспозиции Сmах и AUC(0®t). С этой целью нормированные на номинальную дозу значения анализировались с помощью соответствующей регрессионной модели в рамках дисперсионного анализа. Применялись двусторонние критерии при уровне значимости 0,05. Все данные выражены как среднее арифметическое ± SD, если не указано обратное.
Обсуждение результатов
Каждая из трех групп собак (возраст 1-2 года; масса 7,8-11,4 кг) получала флураланер перорально в одной из трех целевых доз (12,5, 25 или 50 мг/кг). Дозы набирались из целых таблеток, поэтому каждая собака получила дозу, приблизительно равную целевой. Таким образом, для целевой дозы 12,5 мг/кг диапазон составлял 12,0-14,6 мг/кг, для целевой дозы 25 мг/кг – 25,0-28,8 мг/кг, а для целевой дозы 50 мг/кг – 42,2-53,2 мг/кг.
Клинических симптомов или нежелательных явлений после введения флураланера ни у одной собаки не выявлено.
Концентрация флураланера в плазме достигла Смах в среднем в течение одного дня после введения и постепенно снижалась со временем, проходя через более низкие второстепенные пики, возможно, указывающие на перераспределение или рециркуляцию, например, кишечно-печеночную рециркуляцию. Средняя пиковая концентрация в плазме увеличивалась дозозависимым образом. Конечные участки графиков временной зависимости концентрации в плазме были почти параллельны друг другу; в группах, получавших наименьшие дозы, индивидуальная вариабельность для одной и той же дозы была выше, а в группе, получавшей более высокую концентрацию, индивидуальная вариабельность была ниже. Флураланер определялся в плазме (>10 нг/мл) в течение 112 дней после лечения, что указывает на длительное удержание в организме (Рис. 1).
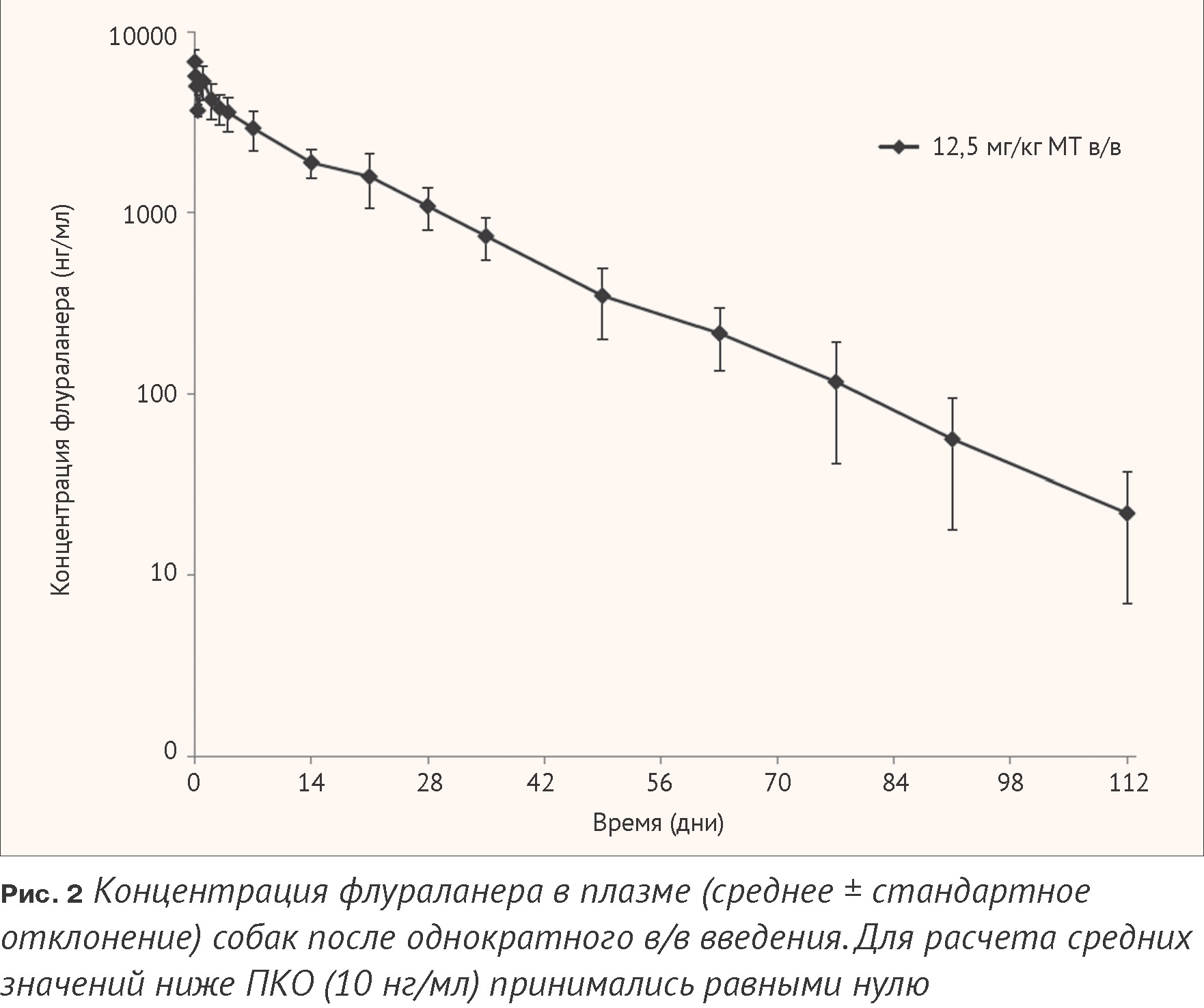
В группе, получавшей препарат внутривенно (12,5 мг/кг), после 5-минутной инфузии наблюдалось очень медленное элиминирование флураланера. У всех собак концентрация флураланера в плазме снижалась со временем, проходя через несколько второстепенных пиков, что может указывать на перераспределение или рециркуляцию, например, кишечно-печеночную рециркуляцию. Флураланер определялся в плазме в течение 112 дней после лечения, что указывает на длительное удержание в организме после в/ введения собакам (Рис. 2).
Некомпартментные фармакокинетические параметры, рассчитанные исходя из данных зависимости концентрации флураланера от времени, представлены в таблице 1.
Общий плазматический клиренс флураланера составил 0,14 л/кг/ день, а средний кажущийся объем распределения флураланера после в/в инфузии – 3,1 л/кг.
Значения среднего периода полувыведения (15 дней) и среднего времени удержания (20 дней) указывают на медленное элиминирование после в/в инфузии. Эти параметры близки к величинам, определенным после перорального введения в различных дозах, и указывают на то, что кинетика элиминирования, по-видимому, не зависит от дозы и способа введения.
Поскольку элиминированию органами выделительной системы могут подвергаться только несвязанные вещества в кровотоке, кажущийся объем распределения и клиренс являются факторами, определяющими терминальное время полувыведения [7-9]. С учетом общего объема воды в организме собаки (приблизительно 0,6 л/кг) [6] флу-раланер имеет относительно высокий кажущийся объем распределения (Vz = 3,1 л/кг) в тканях после в/в инфузии несмотря на высокий уровень связывания с белками плазмы.
Предполагается, что основным путем выведения флураланера является печеночный, так как высокая степень связывания с белками плазмы указывает на незначительную роль почечной фильтрации; как следствие, можно предполагать, что элиминирование из плазмы эквивалентно печеночному клиренсу. Учитывая, что физиологичный кровоток через печень собаки составляет приблизительно 44,5 л/кг/ день [6, 7], а печеночный клиренс флураланера равен 0,14 л/кг/день, печеночная экстракция, по оценкам, является низкой (0,3%). Низкий клиренс в сочетании с относительно высоким распределением в тканях может объяснить длительную системную биодоступность флураланера для собаки.
Биодоступность препарата для перорального применения при низких дозах слегка повышена (34±16%, 26±11% и 20±8%, для 12,5, 25 и 50 мг/кг соответственно).
Однако статистически достоверных различий между группами, получавшими разные дозы по нормированным на дозу параметрам экспозиции AUC(0®t) и Сmax (дисперсионный анализ, р = 0,165 для AUC(0®t) и р = 0,206 для Сmax), не выявлено, что указывает на отсутствие данных, противоречащих нулевой гипотезе пропорциональности дозе флураланера в диапазоне доз от 12,5 мг/кг до 50 мг/кг.
Выводы
Флураланер хорошо всасывается после однократного перорального введения и характеризуется длительным временем полувыведения, длительным временем удержания, относительно высоким кажущимся объемом распределения и низким клиренсом. Эти фармакокинетические характеристики позволяют объяснить значительную продолжительность действия флураланера на блох и клещей у собак после однократного перорального употребления.
Литература
1. Rohdich N., Roepke R.K.A., Zschi-esche E.: A randomized, blinded, controlled and multi-centered field study comparing the efficacy and safety of Bravecto™ (fluralaner) against Frontline™ (fipronil) in flea-and tick-infested dogs. Parasit Vectors 2014, 7:83.
2. Gassel M, Wolf C, Noack S, Williams H, Ilg T.: The novel isoxazoline ectoparasiticide luralaner: selective inhibition of arthropod yaminobutyric acid and L-glutamate-gated chloride channels and insecticidal/ acaricidal activity. Insect Biochem Mol Biol 2014,45:111-124.
3. Ozoe Y., Asahi M., Ozoe F, Nakahira K., Mita T.: The antiparasitic isoxazoline A1443 is a potent blocker of insect ligand-gated chloride channels. Biochem Biophys Res Commun 2010, 391:744-749.
4. Walther F.M., Allan Ml, Roepke R.K.A., Nuernberger M.C.: The effect of food on the pharmacokinetics of oral luralaner in dogs. Parasit Vectors 2014,7:84.
5. OECD: Series on Principles of Good Laboratory Practice and Compliance Monitoring No.1. OECD Principles of Good Laboratory Practice (as revised in 1997). Paris: OECD Environmental Health and Safety Publications, ENV/MC/CHEM(98)17; 1998.
6. Davies B, Morris T.: Physiological parameters in laboratory animals and humans. Pharm Res 1993, 10(7):1093-1095.
7. Toutain P.L., Bousquet-Melou A.: Clearance. J Vet Pharmacol Ther 2004, 27:415-425.
8. Toutain P.L., Bousquet-Melou A.: Plasma terminal half life. J Vet Pharmacol Ther 2004,27:427-439.
9. Toutain P.L., Bousquet-Melou A.: Volumes of distribution. J Vet Pharmacol Ther 2004, 27:441-453.


Назад в раздел

















