Терапевтический потенциал контроля уровня ПТГ и гиперфосфатемии у кошек с ХБП
Автор (ы): Р.А Леонард, ветеринарный врач, кандидат ветеринарных наук, президент Научно-практической Ассоциации ветеринарных нефрологов и урологов (НАВНУ, Россия)
Журнал: №1 - 2020
на правах рекламы
Хроническая болезнь почек (ХБП) у кошек является многофакторным заболеванием, прогрессирующим параллельно необратимым процессам деструкции в почечной паренхиме (нефросклероз). Колоссальный компенсаторный резерв этого парного органа является причиной того, что внешние проявления патологии возникают только тогда, когда повреждается более чем 3/4 форменных элементов почек (итогом этого является клинический этап почечного континуума[1]).
Диагностика ХБП сегодня осуществляется ветеринарными врачами чаще в безапелляционной привязке к повышению уровня азотемии и определенному набору клинических проявлений (иными словами, нет повышения уровня мочевины и креатинина – нет ХБП). Фактически, начальные стадии заболевания остаются незамеченными.
Крайне мало внимания уделяется и другим этиопатогенетическим факторам прогрессирования ХБП, таким как, минерально-костные осложнения.
Начинается каскад минерально-костных осложнений ХБП с гиперфосфатемии. Нарушения в экскреции фосфора возникают у пациентов еще на доклинических этапах почечного континуума. Длительное поддержание почками уровня фосфора в организме в пределах нормы возможно благодаря повышению выработки таких фосфатурических гормонов, как паратиреоидный гормон (ПТГ), фактор роста фибробластов-23 (FGF-23) и тиреокальцитонин (кальцитонин). Хроническая гиперфосфатемия, совместно с гипокальциемией и дефицитом активной формы витамина D3 (кальцитриол) приводит у больных с ХБП к развитию вторичного и третичного гиперпаратиреоза, в результате чего гиперпродукция ПТГ (имеющего рецепторы второго типа практически во всех тканях и органах, что и обусловливает его универсальный токсический эффект) становится неконтролируемой. Фосфатурические гормоны, и особенно ПТГ, являются значимыми, а в некоторых случаях ведущими факторами эндогенной интоксикации у животных с ХБП (именно они, а не азотемия, которая выступает, лишь маркером почечного поражения) и прямо коррелируют с тяжестью клинических проявлений и уровнем летальности этой патологии.
Даже полное прекращение поступления фосфора в организм кошек с ХБП не способно значимо повлиять на тяжесть вторичного/третичного гиперпаратиреоза. Поэтому контроль над балансом фосфора в организме необходимо начинать еще на ранних стадиях ХБП. Для этой цели используются следующие терапевтические тактики: снижение потребления фосфора с пищей (посредством высокоактивных и безопасных фосфат-байндеров) и увеличение его элиминации почками (нефропротективная терапия, использование некоторых петлевых диуретиков).
Однако самый значимый и пролонгированный эффект в смысле поддержания качества жизни и ее продолжительности удается достичь только с помощью антипаратиреоидных средств. Но эта группа препаратов, состоящая на сегодняшний день лишь из трех активных молекул заимствована из медицины человека и имеет крайне высокую курсовую стоимость. Поэтому, разработка и внедрение в широкую ветеринарную практику антипаратиреоидных препаратов, созданных специально для кошек и способных в разы увеличить доступность этой жизненно важной для животных с ХБП терапевтической тактики имеет чрезвычайное важное значение. Проведенное клиническое исследование позволило оценить эффективность одного из таких средств.
Материалы и методы
КИ выполнено согласно ПКИ КФп-К-01/2019 (приказ Минсельхоза России № 101 от 05.06.18 г.) на базе ветеринарной клиники «Доберман» (г. Челябинск) в 2019 г. В исследование включены 39 беспородных кошек обоего пола 1-8 лет с 1-2 стадии ХБП, сопровождающейся гиперфосфатемией (>1,65 моль/л) и нарушением соотношения Са/Р; без сопутствующих патологий. В КИ не включались беременные и лактирующие кошки. Распределение целевых животных по группам (опытная и контрольная) выполнено в случайном порядке.
Схема лечения в контрольной группе (стандартный протокол, курс 6 недель):
1. Телмисартан 1 мг/кг внутрь 1 раз в сутки
2. Лерканидипин 1,25 мг/кг внутрь 1 раз в сутки
3. Торасемид 0,625 мг/кошку один раз в 48 ч
4. Сулодексид 0,3 мл/на животное подкожно 1 раз в сутки.
В опытной группе к данной схеме (стандартный протокол) был добавлен Кафорсен® раствор для перорального применения в дозе 1 капля/кг веса 2 раза в день 2 курса по 3 недели с интервалом 24 часа.
Оцениваемые показатели: общее клиническое состояние; уровень паратгормона (ПТГ), биохимические показатели крови (фосфор, ионизированный и общий кальций, соотношение Са/Р, общий белок, мочевина, креатинин, глюкоза, АСТ, АЛТ, ЩФ, общий и прямой билирубин); общеклинический анализ мочи.
Периодичность оценки: перед началом лечения, через 3 и 6 недель после начала лечения согласно КИ.
Оборудование: биохимический анализатор BioChem SA (HTI ,США); мочевой анализатор Unico CL-50 (США); тест-полоски Urine RSH10, (Emerge Europe, Нидерланды); аппарат УЗИ Diagnostic ultrasound systems 2200V (HDI-Lim, США).
Статистический анализ данных проведен с использованием программы Prism 7.01 общепринятыми методами.
Результаты
На момент включения в КИ у всех кошек были выявлены гиперфосфатемия, нарушение соотношения Са/Р, отклонения показателей осадка мочи, свидетельствующие о патологии почек (цилиндры, почечный эпителий и проч.), УЗИ-признаки нефоросклероза 1-2 степени, протеинурия; около 40% животных с гипостенурией. Состояние животных стабильное.
Исходный уровень ПТГ в опытной и контрольной группах был существенно выше, чем у здоровых животных: 32,9±4,81 и 44,6±5,14 пмоль/л, соответственно (различия между группами статистически незначимы). В опытной группе уровень ПТГ на протяжении всего периода наблюдений достоверно снижался, тогда как в контрольной группе ни у одного животного не отмечена положительная динамика (Табл. 1).
Таблица 1. Динамика изменения основных показателей минерального обмена
|
Показатель |
Норма |
Опытная (n=18) |
Контрольная (n=21) |
||||
|
до |
Через 3 недели |
Через 6 недель |
до |
Через 3 недели |
Через 6 недель |
||
|
Паратгормон
|
4-15 & пмоль/л |
32,9±4,81 |
19,2±2,09** |
15,9±1,88** |
44,6±5,1 |
46,2±5,22### |
47,8±5,20### |
|
Фосфор |
1,1 -1,6 ммоль/л |
2,04±0,08 |
1,70±0,07* |
1,48±0,07*** |
2,51±0,12## |
2,61±0,11### |
2,77±0,12### |
|
Кальций общий |
2-2,7 ммоль/л |
2,78±0,09 |
2,68±0,09 |
2,34±0,09** |
2,49±0,08# |
2,51±0,07 |
2,66±0,05## |
|
Кальций ионизированный |
1,1-1,3 ммоль/л |
1,35±0,09 |
1,22±0,05 |
1,08±0,05 |
1,28±0,07 |
1,31±0,07 |
1,40±0,06### |
|
Соотношение Са/Р |
1,6-2,3 |
1,37±0,04 |
1,59±0,07* |
1,57±0,08 |
1,01±0,04### |
0,98±0,04 |
1,13±0,07### |
|
ЩФ
|
<60 ед/л |
88,7±3,49 |
64,6±5,29*** |
53,7±4,85*** |
75,1±2,57## |
77,3±2,00# |
79,7±2,00*### |
Внутригрупповое сравнение (до – после): * р<0,05; ** р<0,01; *** р<0,001
Межгрупповое сравнение (опыт-контроль): # р<0,05 ; ## р<0,01 ; ### р<0,001
& - за референсный интервал прият уровень ПТГ, полученный при исследовании крови клинически здоровых кошек
Одновременно со снижением ПТГ в опытной группе понизилось (нормализовалось) содержание фосфора: c 2,04 ±0,08 ммоль/л до 1,70±0,07 ммоль/л (р<0,05) и 1,48±0,07 ммоль/л (р<0,01) через 3 и 6 недель от начала терапии, соответственно. К концу наблюдений у 83,3% кошек (15 из 18 животных) фосфор находился в пределах физиологической нормы.
В контрольной группе, напротив, тенденция была обратной – отмечено дальнейшее повышение фосфора в крови – до 2,77±0,12 ммоль/л (Табл. 1).
Различный тренд фосфора в группах обеспечил разницу в динамике изменения Са/Р соотношения. Через 6 недель Са/Р соотношение в опытной группе приблизилось к нормальным значениям 1,57±0,08, тогда как в контрольной группе оно по-прежнему оставалось существенно ниже нормы: 1,13±0,07 (Табл. 1).
Щелочная фосфатаза (ЩФ) рассматривалась в данном исследовании как один из маркеров минерально-костного обмена. Ее первоначально высокий уровень свидетельствовал об активной резорбции костной ткани под влиянием ПТГ. В опытной группе уровень ЩФ на протяжении всего периода КИ достоверно снижался и достиг нормальных значений; в контрольной группе, напротив, активность ЩФ увеличилась (Табл. 1). И, если в начале КИ активность ЩФ в опытной группе была выше, чем в контроле (88,7±3,49 ед/л против 75,1±2,57 ед/л, р<0,01), то в конце наблюдений наоборот, стала ниже (53,7±4,85 ед/л против 79,7±2,00 ед/л, р<0,001). Рост активности ЩФ в контрольной группе коррелировал с повышением содержания кальция в крови (Табл.1).
Другие биохимические показатели в течение всего периода наблюдений находились в пределах референсных значений. Уровень креатинина не превышал 156 ммоль/л.
Анализ мочи. В ходе лечения кошек опытной группы плотность мочи возросла с 1,038±0,0040 г/см3 до 1,104±0,0273 г/см3 (p<0,05), тогда как в контрольной группе, наоборот, проявилась гипостенурия. Интенсивность протеинурии достоверно снижалась как в опытной, так и в контрольной группе (Табл. 2).
Таблица 2. Динамика изменения основных показателей мочи.
|
|
Показатель |
Норма |
Опытная группа (n=18) |
Контрольная группа (n=21) |
||||
|
до |
3 нед |
6 нед |
до |
3 нед |
6 нед |
|||
|
1 |
Удельный вес, г/см3 |
˃1,035г/см2 |
1,038±0,0040 |
1,057±0,0146 |
1,104±0,0273* |
1,040±0,0044 |
1,035±0,0035 |
1,034±0,0033# |
|
2 |
рН |
5-7,5 |
6,3±0,21 |
6,3±0,16 |
6,3±0,15 |
6,4±0,18 |
6,4±0,11 |
6,3±0,11 |
|
3 |
Белок, г/л |
<0,1g/L |
1,3±0,28 |
1,4±0,25 |
0,8±0,14 * |
1,4±0,27 |
1,1±0,21 |
0,9±0,18* |
Внутригрупповое сравнение (до – после): * р<0,05;
Межгрупповое сравнение (опыт-контроль): # р<0,05
Анализ микроскопии осадка и других биохимических показателей значимых изменений и отклонений не выявил.
Общее состояние кошек на протяжении всего периода наблюдений было стабильным. Значимого ухудшения во время лечения не отмечено ни у одного животного. Побочных реакций и/или нежелательных явлений не было отмечено ни в одной из групп.
Дополнительный статистический анализ
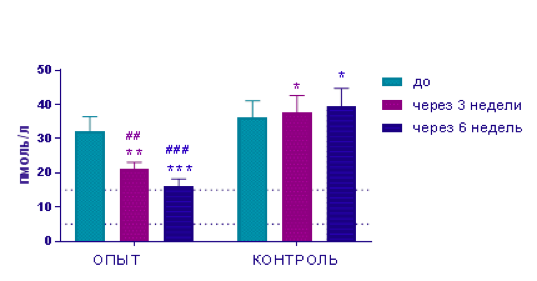
Для того, чтобы исключить влияние животных с экстремальными значениями ПТГ и фосфора, проведен дополнительный статистический анализ, в результате которого заданные более жесткие критерии однородности выборки были выполнены для 14 животных из каждой группы. Все клинически значимые изменения в оптимизированной выборке полностью согласуются с представленными выше результатами. В частности, в опытной группе уровень ПТГ и фосфора через 3 и 6 недель лечения значимо ниже, чем в контрольной (Табл. 3, рис.1 и 2).
Таблица 3. Динамика изменений ПТГ и фосфора в сыворотке крови (оптимизированная выборка).
|
№ |
Показатель |
Норма |
Опытная группа (n=14) |
Контрольная группа(n=14) |
||||
|
до |
через 3 недели |
через 6 недель |
до |
через 3 недели |
через 6 недель |
|||
|
3 |
Паратгормон |
4-15 пмоль/л |
32,3±4,13 |
21,2±1,89** |
16,0±2,27*** |
36,1±4,9 |
37,6±5,00*## |
39,5±5,23** ### |
|
4 |
Фосфор |
1,1 -1,6 ммоль/л |
2,05±0,09 |
1,71±0,09*** |
1,50±0,08*** |
2,27±0,10 |
2,32±0,10### |
2,49±0,10### |
Внутригрупповое сравнение (до – после): * р<0,05; ** р<0,01; *** р<0,001
Межгрупповое сравнение (опыт-контроль): # р<0,05 ; ## р<0,01 ; ### р<0,001
Рисунок 1. Динамика уровня паратгормона (оптимизированная выборка).
Заключение
Результаты проведенного клинического исследования у кошек с нарушением кальций-фосфорного обмена на фоне хронической болезни почек продемонстрировали целесообразность использования препарата Кафорсен® раствор для перорального применения для коррекции гиперфосфатемии на фоне высокого содержания паратиреоидного гормона в сыворотке крови.
Поскольку ХБП является хроническим и неуклонно прогрессирующим заболеванием, рекомендовано дальнейшее исследование лечебно-профилактических свойств препарата Кафорсен® раствор для перорального применения в терапевтических схемах, длительностью более 6 недель и у пациентов с III-IVстадией ХБП.
[1] Почечный континуум — это промежуток времени от появления первых гистоморфологических изменений в почечной паренхиме, диагностируемых обычно с помощью световой и/или электронной микроскопии до момента гибели пациента от последствий почечной недостаточности.

Назад в раздел


















