Мультирезистентные стафилококки в ветеринарной дерматологии. Что мы должны сделать для эффективного лечения пиодермии? (Материалы 4-го Международного ветеринарного дерматологического симпозиума)
Еще фото
Автор (ы): Клод Фавро, профессор, глава отделения дерматологии ветеринарного факультета Цюрихского университета, дипломант ECVD / Claude Favrot, Pr., Dr.vet. med, Dipl. ECVD, Dermatology Department, Head Clinic for Small Animal Internal Medicine Vetsuisse Faculty University of Zurich
Журнал: №3 - 2015
Перевод с английского: Михаил Демидов
В своей лекции я попытаюсь ответить на несколько вопросов:
- Почему возникает бактериальное воспаление?
- Что такое мультирезистентность?
- Каким образом бактерии становятся устойчивыми?
- Что сегодня мы можем сделать для решения этой проблемы?
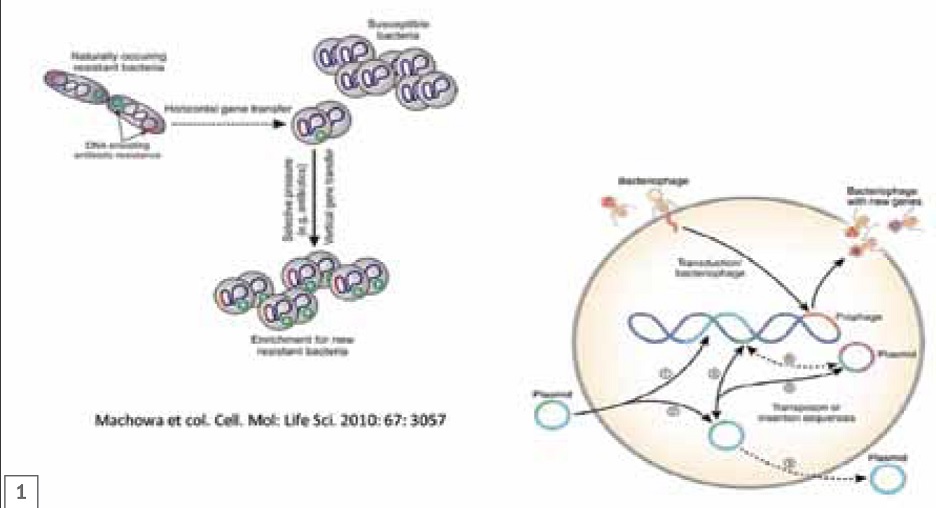
Есть три основных способа приобретения новых элементов генома для бактериальной клетки.
1. Трансформация — это процесс, при котором элемент генома, находившийся в окружающей среде (например, транспозон или плазмида находились в межклеточном пространстве), так или иначе попал в бактериальную клетку и встроился в ее геном.
2. Трансдукция — это механизм, при котором бактериофаги (вирусы малого размера с тропностью к конкретным бактериям) поражают одну бактерию за другой.
3. Конъюгация возникает при непосредственном контакте бактерий. За счет того, что 2 бактерии конъюгируют, они могут обмениваться элементами генома. Таким способом некоторые бактерии могут приобретать резистентность.
Все вышесказанное можно проиллюстрировать рисунком 1. Например, на коже находятся 2 бактерии (из сотен) и нерезистентный к цефалоспоринам стафилококк. Но также есть и другие стафилококки, резистентные к этому препарату, например, золотистый стафилококк, у которого есть плазмиды. Плазмиды, выделенные красным цветом – резистентны, а выделенные зеленым – нерезистентны. Предположим, что мы начинаем назначать лечение антибиотиками. В результате, погибает 99% чувствительных микроорганизмов (100% никогда не погибает), но обязательно после лечения остаётся некоторое число бактериальных клеток. Особенно это происходит в том случае, если дозировка цефалоспорина была недостаточно высокой. Выжившие бактериальные клетки начнут быстро размножаться, поскольку имеется достаточное количество питательной среды, а конкуренция малая. За счёт такого быстрого размножения некоторые гены резистентности будут высвобождаться в окружающую среду, и те бактерии, которые не были раньше чувствительными, приобретут эти гены. Например, Staphylococcus pseudintermedius станет резистентным за счёт золотистого стафилококка, который был резистентным и обеспечил передачу элементов генома. Таким образом, происходит вертикальная передача элементов генома за счёт размножения бактериальной клетки из одной или нескольких. За счёт обмена элементами генома S. pseudintermedius может приобрести новые характерные черты.
Ещё один способ приобретения резистентности — посредством бактериофагов. Вирусы малого размера, которые, как правило, имеют тропность к конкретным видам бактерий, способны перемещать элементы генома от одной бактерии к другой и в итоге обусловливать возникновение резистентности у некоторых видов бактерий.
Первый механизм называется трансформация, второй – трансдукция, но результат получается одинаковым.
Мультирезистентные стафилококки
Часто мы думаем о мультирезистентных и метициллин-резистентных стафилококках как о практически синонимичных терминах. В общем, это не совсем так. Большинство мультирезистентных стафилококков действительно являются метициллин-резистентными. В ветеринарной литературе собак, кошек, лошадей и рогатого скота описано 3 основных группы.
• Метициллин-резистентный S. pseudintermedius. Его название возникло около 5-6 лет назад. Это бактерии, которые имеют тропность в основном к организму собаки, но могут встречаться и на коже людей, находящихся в контакте с больными собаками.
• Метициллин-резистентный золотистый стафилококк. Он скорее присущ человеку, поэтому если вы встречаете его у кошек или у коров, то, вероятнее всего, он получен животными от своих владельцев.
• Метициллин-резистентные коагулазонегативные стафилококки. Очень долгое время считалось, что это не очень опасная группа. На сегодняшний день дело обстоит иначе, поскольку некоторые из них приобрели гены метициллин-резистентности и стали представлять опасность.
В чем заключается проблема метициллин-резистентных штаммов? Дело в том, что метициллин-резистентные стафилококки резистентны ко всем бета-лактамным препаратам и к цефалоспоринам. Кроме того, нередко метициллин-резистентные стафилококки также демонстрируют резистентность к некоторым другим группам антибиотиков.
Наиболее часто встречающийся штамм в Европе – это штамм ST71. Он, как правило, демонстрирует резистентность ко всем цефалоспориновым препаратам и препаратам пенициллинового ряда, что входит в определение метициллин-резистентного. Более того, эта резистентность обусловлена геном mecA. Однако, есть другие гены резистентности, например ген erm(B), который обусловливает резистентность к эритромицину и клиндамицину. Также есть гены, которые обусловливают резистентность к триметоприм-сульфаниламиду или к препаратам тетрациклинового ряда. Мутации в гиразах и топоизомеразах в итоге приводят к резистентности к энрофлоксацину и другим фторированным хинолонам. Таким образом, спектр генов весьма широк, как и спектр препаратов, к которым имеется резистентность.
Нередко, при лечении инфекций, вызванных штаммом ST71, в арсенале ветврача оказывается не так много антибиотиков, таких как ванкомицин, линезолид, рифампицин, фузидиевая кислота (которая не так легко применима в клинике), поскольку в гуманной медицине они считаются препаратами резерва.
Обратимся к некоторым деталям генома штамма ST71. Есть некоторые подтипы этого штамма, которые отличаются по элементам генома (Рис. 2). В основном, речь идет о пиодермии, но возможны и другие поражения. Так, при пиодермии у собак в 54% случаев был выделен S. pseudintermedius, в том числе в 5% случаев – штамм ST71, остальной процент приходится на другие разновидности. Первый штамм резистентен к большому числу препаратов, таких как стрептомицин, гентамицин, эритромицин, клиндамицин. Это выделено малым индексом R напротив названия конкретного антибиотика. У некоторых штаммов есть даже тетрациклиновая резистентность. Из этого можно сделать вывод, что выбор антибиотиков весьма ограничен. В некоторых случаях можно использовать тетрациклин (на слайде выделен зелёным цветом), а есть штаммы, которые вообще нечувствительны ни к чему.
Поговорим теперь о коагулазонегативных мультирезистентных стафилококках. Несколько лет назад мы провели в Швейцарии исследование, в котором постарались соотнести некоторые штаммы коагулазонегативных стафилококков, например S. epidermidis и S.haemolyticus, и заболевания, вызванные этими возбудителями (заболевания дыхательных путей, кожи, абсцессы, инфекции мочевыводящих путей, суставы, глаза, инфекции ушей). Все органы так или иначе могут поражаться инфекцией, вызванной S. epidermidis. В связи с наличием мультирезистентных штаммов очень трудно лечить такие заболевания. Также мы наблюдали 17 случаев, вызванных стафилококком S.haemolyticus. Это такие заболевания, как дерматит, инфекции мочевыводящих путей, абсцессы, инфекции дыхательных путей и ушей.
Из наблюдений стало ясно, что все штаммы стафилококка S. epidermidis (20 наблюдений) резистентны к бета-лактамам, 13 штаммов резистентны к гентамицину и т.д. (Рис. 3). И только в 2-х случаях у этого стафилококка мы наблюдали резистентность к хлорамфениколу, поэтому именно он служил для нас препаратом выбора. Таким образом, коагулазонегативные стафилококки, не вызывавшие ранее серьёзных опасений, на сегодняшний день выглядят весьма угрожающе.
То же самое касается гемолитического стафилококка (Рис. 4). Из 17 случаев подавляющее большинство штаммов демонстрирует резистентность практически ко всем антибиотикам, за исключением фузидиевой кислоты и хлорамфеникола. Это означает, что эти 2 препарата становятся препаратами выбора.
Действительно ли проблема резистентности стафилококков так велика?
В прошлом году был опубликован материал, в котором была собрана обобщенная информация по всем европейским исследованиям о мультирезистентности стафилококков. В этом мета-анализе можно увидеть, что все исследования единодушно сходятся во мнении о том, что от 40% до 50% стафилококков хотя бы к чему-то резистентны. Семь из проведенных исследований демонстрируют высокие показатели резистентности. В 2-х исследованиях пришли к выводу, что все штаммы стафилококков резистентны к какому-либо препарату. Сейчас в Европе по меньшей мере 80% штаммов стафилококков так или иначе демонстрируют антибиотикорезистентность, чего не было 20 лет назад. Это подчёркивает первоочередную значимость этой проблемы.
Теперь поговорим о метициллин-резистентном S. pseudintermedius. В результате исследований, проведенных в разных странах, было установлено, что число мультирезистентных штаммов S.pseudintermedius в Великобритании составило 5%, в Германии 13%, в Италии 21%, в Швейцарии (по неопубликованным данным) 15%, во Франции около 17%.
После публикации данных по Великобритании многие усомнились в их правдивости, считая, что цифры специально были занижены, чтобы снизить значимость данной проблемы. Из всех стафилококков 80% — резистентны к каким-либо антибиотикам, а из этих 80% около 10-20% — это мультирезистентный S. pseudintermedius.
Механизм резистентности
Мы уже упоминали, что имеются мутации, которые обусловливают резистентность к фторхиналонам, и есть способы приобрести гены резистентности путем конъюгации, трансформации или трансдукции. Этот механизм вызывает резистентность к бета-лактамным препаратам. Итак, когда бактерии приобретают гены резистентности, они вырабатывают специальные ферменты, которые начинают инактивировать антибиотик, т.е. антибиотик проникает в бактериальную клетку, но не уничтожает ее из-за ферментной активности бактериальной клетки. Очень часто, в том числе за счет гена mecA, бактерия защищается путем изменения мишени антибиотика. Например, происходит изменение структуры пенициллин-связывающего белка PBP2a таким образом, что пенициллин теряет всяческую аффинность и перестает связываться со своей мишенью в бактериальной клетке, в результате чего развивается неэффективность такого антибиотика. Кроме того, еще одной возможностью развития резистентности является так называемая Efflux-опосредованная лекарственная устойчивость. То есть антибиотик поступает в бактериальную клетку, однако, за счет наличия специальной помпы, Efflux-система выкачивает антибиотик из бактериальной клетки таким образом, что необходимая концентрация антибиотика в клетке не достигается. Поэтому наличие Efflux-системы в бактериальной клетке также представляет собой важную проблему. Кроме того, при некоторых вариантах метаболизма антибиотики иначе метаболизируются, в связи с чем не оказывают своего действия.
По большому счету мы имеем два основных способа приобретения генов резистентности. Первым из них является способ мутации. Наилучший пример – это мутация ДНК топоизомеразы, которая в итоге индуцирует резистентость к препаратам фторхинолонового ряда. Частота мутаций весьма невысока: после каждого цикла деления на каждые 10 миллионов бактерий возникает примерно 1 резистентная бактериальная клетка.
Есть два основных гена, которые индуцируют резистентность к топоизомеразе: гены, которые кодируют топоизомеразу 2 и топоизомеразу 4. В составе любой из топоизомераз, будь то 2 или 4, есть очень маленький фрагмент, модификации которого путем мутации достаточно для того, чтобы развилась резистентность к препаратам фторхинолонового ряда. Если обратиться к более подробной разбивке, можно увидеть, насколько широк спектр мутаций, который был выявлен у стафилококка S. pseudintermedius. Большое число таких мутаций не затрагивает те элементы генома, которые ответственны за возникновение фторхинолоновой резистентности. Однако если посмотреть внимательнее, можно увидеть в первом случае 5, во втором случае 5 и в случае 4-й топоизомеразы – 2 мутации, которые приводят к мутации, обусловливающей резистентность к фторхинолонам.
К счастью, очень часто мутации происходят в других участках генома, но иногда, если нужная мутация приходится в нужную точку, развивается фторхинолоновая резистентность. Если собака не получала фторхинолоны (например, если вы не давали собаке энрофлоксацин), то нет ничего страшного в присутствии этого гена, потому что эта единичная бактериальная клетка через несколько циклов деления исчезнет, и мы не спровоцируем возникновение штамма, резистентного к фторхинолону. Однако, если такая мутация происходит во время курса лечения энрофлоксацином, то эта единственная бактериальная клетка имеет возможность размножаться быстро, и в очень короткий период времени вы получите огромную популяцию фторхинолон-резистентных стафилококков.
Приобретение генов, ответственных за резистентность (трансдукция, трансформация или конъюгация)
Некий ген, который отвечает, например, за изменение структуры пенициллин-связывающего белка – это важный ген, приводящий не только к устойчивости стафилококка к пенициллину, но и к резистентности к широкому спектру препаратов бета-лактамного ряда.
Ген mecA был открыт довольно давно, его впервые описали более чем 50 лет назад. Этот ген возник на самой заре эры антибиотиков. То есть через 10 лет, после того как появились антибиотики, уже появились штаммы первых мультирезистентных золотистых стафилококков.
Все эти стафилококки обладают так называемыми стафилококковыми хромосомными кассетами, мобильными элементами генома. Хромосомные кассеты – это очень крупные элементы генома. В их составе находится не только ген mecA, но и другие гены, например, гены резистентности к тетрациклину, эритромицину, линкозамиду и другим антибиотикам. Именно за счет того, что этот мобильный элемент генома настолько велик по своему размеру и в его составе содержится большое количество элементов генома, возникает мультирезистентность, потому что если приобретается такая резистентность, то сразу к большому количеству антибиотиков. Итак, золотистый стафилококк – сегодня можно говорить с большой степенью уверенности – приобрел эти гены от других стафилококков. Staphylococcus sciuri и S. pseudintermedius, которые встречаются у собак, получили свои гены от золотистого стафилококка. Это горизонтальная передача генов, которая обусловливает большое количество бактерий, делящихся между собой генами одного свойства.
Итак, этот ген кодирует пенициллин-связывающие белки PBP2a и меняет мишень для связывания антибиотиков пенициллинового ряда. За счет того, что аффинность антибиотика теряется, он не ингибирует бактериальный рост, и бактерии даже в присутствии антибиотика начинают активно размножаться. Например, хромосомная кассета стафилококка, содержащая другие гены, дает резистетность к эритромицину, линкомицину и содержит еще ген aad9, который ответственен за резистентность к стрептомицину и спектомицину. Могут в этой кассете содержаться и гены резистентности к тетрациклину. Есть и другие механизмы резистентности к тетрациклину, которая обеспечивается за счет efflux-системы, то есть тетрациклин проникает в бактериальную клетку и также быстро оттуда выходит, не задерживаясь за счет efflux-системы. Такие efflux-системы присутствуют у большого числа европейских штаммов. Например, у штамма 71 мультирезистентного стафилококка наблюдается резистентность к препаратам тетрациклинового ряда.
Резистентность к клиндамицину обусловлена другими механизмами. Она связана с геном erm, который очень легко индуцируется при лечении эритромицином. Точно так же как тетрациклины вызывают соответствующий сплайсинг элементов генома и облегчают передачу мобильных элементов генома, то же самое касается лечения эритромицином. Ген erm достаточно легко индуцируется и бактерии приобретают резистентность к клиндамицину в том числе.
Пути предотвращения развития резистентности у стафилококков
В нашей практике довольно часто встречаются пациенты с пиодермией, вызванной стафилококками. Однако большинство стафилококков – это мультирезистентные штаммы, некоторые из них крайне резистентны. Как решить эту проблему? Во-первых, нужно пресечь любую передачу элементов генома и обмена этими элементами. Во-вторых, усовершенствовать диагностику и лечение бактериальной инфекции. Если мы не используем антибиотики, то мы избегаем проблему резистентности, таким образом снижая частоту встречаемости мультирезистентных штаммов. Возможно, именно это является ключевым направлением работы. Использование как можно меньшего числа антибиотиков, а в случае необходимости их использования делать это качественно.
В литературе не всегда доступно объясняется, что такое контаминация, колонизация и инфицирование. Это три разных ситуации. Контаминация означает, что на кожных покровах или на шерсти присутствуют бактерии, однако они не колонизируют организм, т.е. не могут расти и размножаться на конкретной среде, от них достаточно легко избавиться. Однако, по результатам культуральных проб, контаминация все равно будет присутствовать. При исследовании животного вы берете культуру и определяете мультирезистентного стафилококка. Если через какое-то время вы все равно наблюдаете высокие титры этих микроорганизмов, то это может означать колонизацию. Колонизация больше свойственна для перианальной области и области около носа. В случае колонизации через какое-то время последует развитие инфекции.
И последнее – это истинная инфекция, характеризующаяся клиническими признаками, связанными с ростом бактерий.
Каковы же факторы риска в плане развития мультирезистентного стафилококка S.pseudintermedius? В статье Weese et al. (2009) говорится о том, что основной причиной приобретения резистентности является антибактериальное лечение, причем некоторые антибиотики более опасны, чем другие.
Чаще всего резистентность приобретается в ветеринарных клиниках и в частных ветеринарных кабинетах. Если животное не получает антибиотиков и не посещает ветеринарный кабинет, то у него никогда не разовьется резистентность и не появится резистентных бактерий, это важно иметь в виду.
Как же выйти из этого положения? Без необходимости не назначать антибиотикотерапию, выбирать альтернативные способы лечения. У нас всегда был рефлекс: если есть какая-то инфекция, даем антибиотик. Коллеги, такой рефлекс больше неуместен! Необходимо изменить наш взгляд на терапию в целом. Необходима рациональная антибиотикотерапия, тщательно взвешенное назначение антибиотиков (исключительно по необходимости!) и только в случае отсутствия других альтернативных вариантов решения. Если пациентам необходимы антибиотики, важно проводить надлежащее лечение нужным антибиотиком и в правильной дозировке. Выявление таких пациентов играет первоочередную роль.
Гигиенические мероприятия
Надлежащей гигиене рабочего места, рук, рабочей одежды должно уделяться особое внимание. Во всем мире – и в гуманной медицине, и в ветеринарии – говорят про гигиену рук, но адекватно ни медсестры, ни врачи, ни ветеринары руки не обрабатывают. Европейская ветеринарная ассоциация опубликовала простые и наглядные постеры, на которых излагается самая основная информация о том, как лучшим образом обрабатывать руки и рабочие поверхности (Рис. 5). Во время обработки рук необходимо снимать браслеты, кольца, цепочки и т.д., также недопустимо ношение накладных и накрашенных ногтей. В Цюрихе в учебном госпитале мы это строго контролируем. Дезинфекция и мытье рук – это разные вещи, но иногда эти простые положения игнорируют. Использование перчаток ни в коем случае не заменит обработку рук.
Необходимо также уделять внимание адекватному удалению различных отходов разного класса, обработке рабочих поверхностей, столов, смотровых и так далее. Время от времени необходимо проведение различных проб.
Несколько лет назад мы делали проверку различных дезинфицирующих средств. Мы увидели, что не все дезинфицирующие средства действуют так, как заявлено на этикетке. Если на 20 минут оставить средство, оно работает, но мы не можем себе позволить 20-минутную обработку, так как в приемной ждет следующий пациент. По этой причине необходимо время от времени проверять дезинфицирующие средства на предмет их эффективности в зависимости от времени обработки. Возможно, после такой проверки вас ждет множество удивительных и неприятных сюрпризов. Следует уделять больше внимания не только обработке рук, но и ношению специальной рабочей одежды. В нашей борьбе с мультирезистентностью – это основной рубеж обороны.
Распознавание бактериальных заболеваний, дифференциальный диагноз играют важную роль. Пиодермия – термин, обобщающий все разновидности бактериальной инфекции кожи. Наиболее распространенными видами пиодермии являются фолликулит и фурункулёз.
Когда вы видите пиодермию на ранней стадии – это маленькие папулы. Если посеять или сделать цитологию, то можно увидеть бактериальные клетки. Такой собаке потребуются просто антибактериальные шампуни. Если мы видим пустулы, при этом воспалительный процесс достаточно поверхностный или локализован внутри дермы, то пациенту потребуется относительно непродолжительное лечение антибиотиками или, возможно, только местное лечение. При более глубоком поражении необходимо лечение антибиотиками на протяжении 5-6 недель.
При синдроме бактериальной гиперчувствительности, когда бактерии не только присутствуют на коже, но и выделяют эксфолиативный токсин, мы наблюдаем масштабные поражения, необходимо назначить соответствующую антибиотикотерапию. Только шампунем тут не обойтись.
Дифференциальный диагноз необходимо проводить с разными патологиями и собак с такими поражениями не обязательно нужно будет лечить антибиотиками. Если вы не уверены – не надо лечить антибиотиками. Редко возникает такая ситуация, когда при виде животного мы бы сразу смогли поставить диагноз бактериальной инфекции. Чаще всего это один из диагнозов в нашем списке дифференциальных диагнозов, но не является единственным.
Бактериальную инфекцию нужно дифференцировать от дерматофитоза, демодекоза, неоплазии, поскольку неоправданное лечение антибиотиками при этих болезнях приводит к потере времени, дополнительным издержкам и риску создать резистентные штаммы. Поэтому хочется еще раз подчеркнуть важность цитологического исследования. Не назначайте антибиотиков до тех пор, пока вы со всей уверенностью не докажите, что это бактериальная инфекция.
Как это сделать? Можно сделать мазок (особенно если это язва, эрозия), можно вскрыть пустулу иголочкой, можно взять мазок тупфером, т.е. есть масса способов забора материала с поверхности кожи, чтобы затем его микроскопировать (Рис. 6).
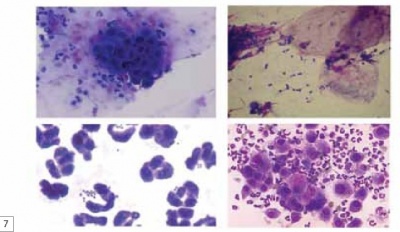
Итак, рассмотрим подробно рисунок 7. В первом случае (наверху слева) мы видим небольшое число бактерий и очень выраженную реакцию со стороны макрофагов и прочих клеток (могут быть лимфоциты, нейтрофилы, плазмоциты и т.д.). То есть мы видим массу клеток, ответственных за воспаление, бактерии. Это очень глубокая бактериальная инфекция, для лечения которой животному потребуется долгий курс антибиотиков.
Другая ситуация (наверху справа) говорит нам о присутствии бактериальных клеток, но небольшом количестве нейтрофилов. Это обычная бактериальная контаминация. В этом случае не нужно лечение антибиотиками, антибактериального шампуня будет достаточно.
На следующем рисунке (внизу слева) в мазке присутствуют нейтрофилы и стафилококки. Видим, что это фолликулит (воспаление волосяного фолликула). В этом случае я подумал бы о назначении антибиотиков собаке, но попробовал бы начать лечение с антибактериального шампуня.
Иногда вы можете увидеть такие картины на цитологии (внизу справа). Это пемфигус (листовидная пузырчатка). Назначение антибиотиков в этом случае неуместно. Необходимо назначать преднизолон, дексаметазон или другие иммунодепрессивные препараты.
Таким образом, цитологическое исследование играет очень важную роль, если у вас еще нет микроскопа, призываю приобрести его.
В каком случае делать посев? Если вы опытный дерматолог и если заболевание кожи для вас выглядит странно, непривычно, если вы понимаете, что не можете поставить диагноз, то логично сделать посев. Вы можете поставить диагноз бактериальной инфекции на основе вашего клинического опыта, на цитологической основе и пролечить собаку должным образом (шампунями и антибиотиками). Если через 3 недели нет никакого улучшения, то, возможно, это связано с наличием резистентных штаммов. После этого есть все основания сделать бактериальный посев. Если ситуация вам незнакома, то сделать посев следует до начала лечения. Пролечив животное 5-6 недель, не зная резистентны бактерии или нет, вы теряете время.
Необходимо выполнять бактериологический посев, когда мы сталкиваемся с пациентами на иммуносупрессии, и если в контакте с животными находятся люди с иммуносупрессией.
Я всегда задаю вопрос владельцам о тех лицах, которые находятся в контакте с животными. Например, в тех случаях, если с животным контактируют лица, имеющие нарушение иммунитета, я выполняю бактериологический посев, чтобы убедиться, что для такого человека животное не представляет угрозы. Профиль резистентности и бактериологическое исследование должно соответствовать тому, какой спектр антибиотиков имеется у вас. В Швейцарии мы из лаборатории получали список из 20 антибиотиков, 18 из которых для собак не продавалось. Поэтому необходимо определять чувствительность к тем антибиотикам, которые доступны в ветеринарной практике.
Идентификация организмов
На сегодняшний день не достаточно получить результаты бактериологического посева об имеющемся стафилококке, одной родовой принадлежности мало. Необходимо знать видовую принадлежность бактерии, будь то S. pseudintermedius, S. haemolitycus, S. aureus, S. felis и другие.
Идентификация до видовой принадлежности играет важную роль, тем более что на сегодняшний день существует достаточно методик для идентификации бактерий, в частности техника матрично-активированной лазерной десорбции/ионизации (МАЛДИ), которая позволяет определить микроорганизм методами масс-спектрометрии по времени пролета частиц. Это дорогой аппарат, но недорогие методы.
Назначение антибиотиков
Для назначения антибиотиков должно быть хорошее обоснование. Во-первых, наличие инфекции, а не контаминации или чего-то другого. Во-вторых, возможность контакта с человеком с иммуносупрессией. В-третьих, если мы пробовали лечить этого пациента другими методами, но улучшения не наступило. Только в этих трех случаях имеет смысл назначить антибиотики. Есть 5 основных молекул, которые наилучшим образом лечат стафилококковые инфекции: хлоргексидин, повидон йод, триклозан, этилактат и перекись бензоила. По сути, это антисептики и дезинфектанты. Если все же от дезинфектантов необходимо будет подойти к антибиотикам, попробуйте амоксиклав (12,5-25 мг/кг, 2 раза в день, 3 недели) или цефалексин (25-30 мг/кг, 2 раза в день, 3 недели).
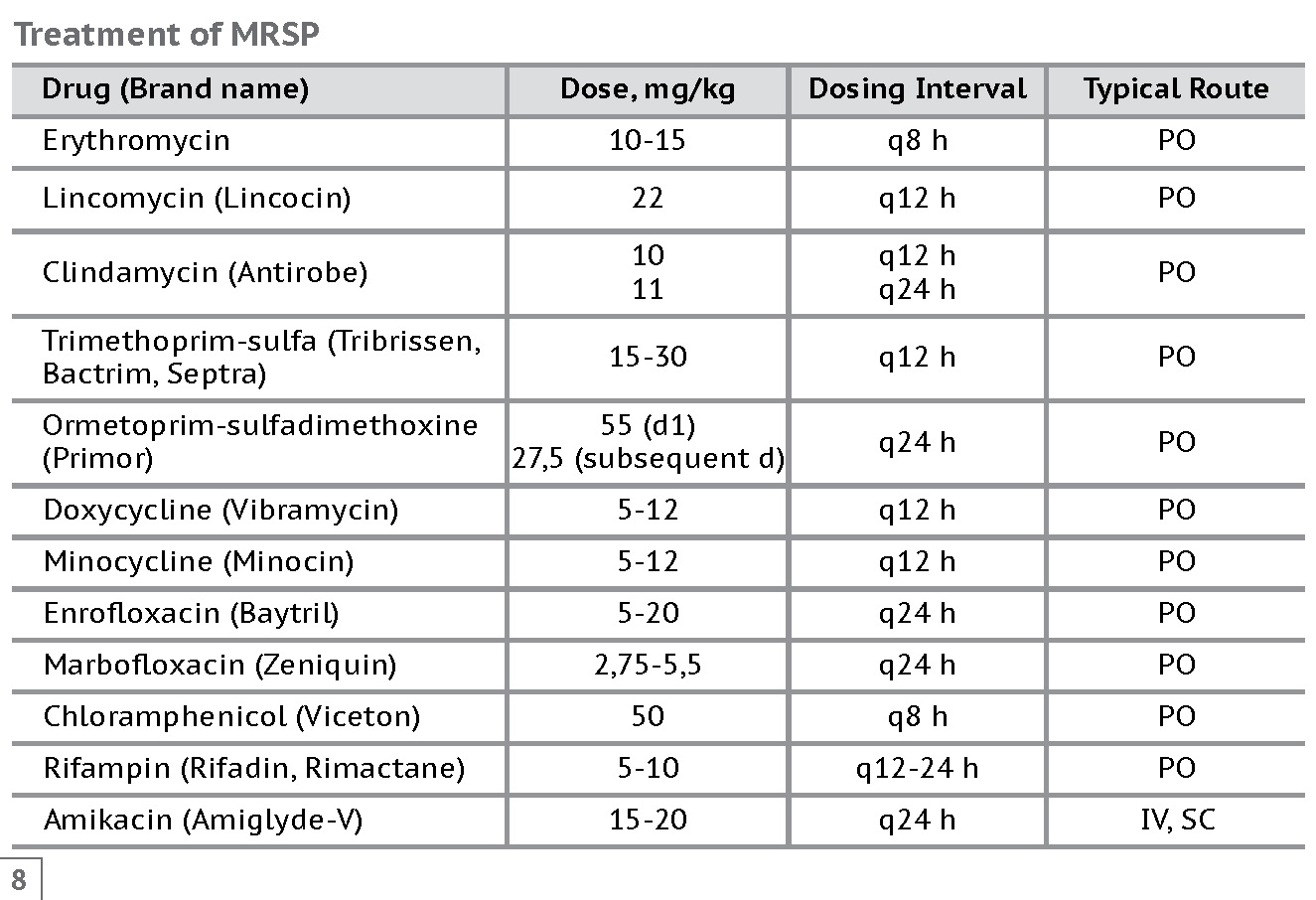
Фторхинолоны при стафилакокковой инфекции не являются препаратами первой линии. Эти препараты используются при смешанной инфекции или полиорганных инфекционных поражениях. Также они используются, когда другие антибиотики неуместны. Если другие антибиотики будут нехороши для конкретных органов и систем, можно попробовать линкозамиды, но до их назначения лучше сделать посев. На рисунке 8 представлены некоторые препараты и дозировки для лечения.
Если мы сталкиваемся с мультирезистентными стафилококками, можно и нужно использовать некоторые альтернативные антибиотики. Для лечения коагулазонегативной инфекции, можно попробовать хлорамфеникол, и пусть вам это не кажется странным. Это препарат 30-летней давности, который в настоящее время является «хорошо забытым старым». Мы знаем, что у кошек он вызывает супрессию костного мозга, диарею и другие проявления со стороны ЖКТ. Его назначение требует очень большой осторожности, потому что он взаимодействует с цитохромом семейства P450 В итоге начинаются сложности при одновременном назначении с противосудорожными препаратами. Но тем не менее, именно он является препаратом выбора.
Рифампицин часто эффективен для лечения стафилококковой инфекции, однако это препарат резерва и не должен использоваться как препарат монотерапии. Как монотерапия он используется в очень коротких курсах, потому что резистентность к нему может возникнуть очень быстро, что было подтверждено в статье Vanduijkeren (2010). Когда собак лечили монотерапией-рифампицином, буквально за три недели образовались резистентные штаммы. Лучше назначать его в сочетании с другими антимикробными препаратами. Необходимо обратить внимание на возникновение супрессии костного мозга, следует с осторожностью принимать пациентам с нарушениями печени.
Амикацин доступен для парентерального применения, иногда можно использовать подкожно, но я не рекомендую, поскольку у него серьезная нефротоксичность и каждые 3 дня нужно контролировать показатели мочи, то есть это значит, что пациент должен наблюдаться амбулаторно.
Другие возможности
Россия была первой страной, где были внедрены бактериофаги. О них забыли только из-за того, что стали успешными антибиотики. Теперь же, когда новых молекул становится все меньше, когда фармкомпании понимают, что разработка каждой новой молекулы требует больших средств и времени, вряд ли в будущем мы станем свидетелями изобретения большого количества новых молекул. С другой стороны, есть фаги, которые тропны к конкретным видам бактерий и способны их уничтожать. Поэтому, на мой взгляд, сегодня дело идет к тому, чтобы выделять конкретные ферменты (лизины) этих фагов, которые ответственны за разрушение бактериальной клетки, и использовать их. Сейчас ведется работа по линии выделения конкретных лизинов бактериофагов и, возможно, именно за этим будущее в лечении инфекций, вызванных стафилококком и другими микроорганизмами.



Назад в раздел

















