Листовидная пузырчатка
Еще фото
Автор (ы):
А.Н.Герке, к.в.н., врач-дерматолог ветеринарной клиники «СовВет», член Европейского общества ветеринарных дерматологов (ESVD), Санкт-Петербург/
A.Gerke.,DVM, PhD, St.-Petersburg
Журнал: №5 - 2016
УДК 619:616.527.8
Ключевые слова: листовидная пузырчатка, собака, кошкаKeywords :pemphigus foliaceus, dog, cat
Аннотация
Пузырчатки – группа аутоиммунных заболеваний кожи с образованием интраэпидермальных пузырей в результате нарушения межклеточных взаимосвязей (антолиза). Типы пузырчаток классифицируются в зависимости от локализации пузырей в эпидермисе, различают поверхностные (пузырчатка листовидная, IgA пузырчатка) и глубокие (пузырчатка обыкновенная, пузырчатка вегетирующая и паранеопластическая пузырчатка). В статье рассмотрены распространенность, клинические признаки, гисто- и иммунопатология, лечение листовидной пузырчатки у собак и кошек.
Summary
Тhe pemphigus denomination encompasses a group of autoimmune blistering skin diseases with intraepidermal separation resulting from cell–cell detachment by acantholysis. Entities are classified based on the level of blistering in the epidermis, and both superficial (pemphigus foliaceus, IgA pemphigus) and deep (pemphigus vulgaris, pemphigus vegetans and paraneoplastic pemphigus) variants are recognized. This article reviews up-to-date knowledge on the epidemiology, clinical signs, histopathology, immunopathology and treatment outcome of canine and feline pemphigusfoliaceus.
Введение
Листовидная пузырчатка – самая распространенная аутоиммунная болезнь кожи у собак и кошек. Этот дерматоз проявляется пустулами и корочками, вызванными поражением эпидермиса. Известно, что клетки эпидермиса между собой соединяются при помощи десмосом или гемидесмосом. При воздействии аутоантител на белки-мишени в этих адгезионных структурах происходит образование полостей внутри или под эпидермисом, что является характерным признаком заболеваний кожи из группы пузырчаток [5]. Эти болезни достаточно редки, частота встречаемости не превышает 5 случаев на 1000 животных. Листовидная пузырчатка поражает эпидермис, оказывая воздействие на различные молекулы адгезии, особенно десмосомы, удерживающие кератиноциты вместе, основным аутоантигеном у собак является десмоколлин-1 [1]. Поскольку основной мишенью аутоантител при листовидной пузырчатке у человека является гликопротеиддесмоглеин-1 (DSG-1) в десмосомах, ранее он же считался основной мишенью и у собак [19]. Более поздние исследования с использованием непрямой иммунофлуоресценции (IIF) показали, что только у 6% собак с листовидной пузырчаткой в сыворотке крови обнаруживали аутоантитела IgG к десмоглеину-1 (DSG-1). В связи с этим в настоящее время десмоглеин-1 считается малозначимым антигеном для собак [23].
По-видимому, генетические факторы могут предрасполагать к развитию ряда аутоиммунных болезней. Данные, собранные в нескольких исследованиях, свидетельствуют о том, что пузырчатка чаще диагностируется у собак определенных пород. Предрасположены бородатые колли, акиты, ньюфаундленды, шипперке, доберманы, финские шпицы [12], таксы [26], английские кокер-спаниели, чау-чау, колли и шелти [22].У кошек породной предрасположенности не установлено, хотя есть тенденция к большей вероятности возникновения пузырчатки у короткошерстных кошек [24]. Возраст первых проявлений болезни различен, в разных исследованиях колеблется от нескольких месяцев до 17 лет [22].
Предрасполагающим фактором для возникновения листовидной пузырчатки может быть ультрафиолетовое излучение, в летний период наблюдают сезонные обострения заболевания, также летом может возникнуть необходимость увеличения дозы иммуносупрессивных препаратов в теплое время года [15]. В качестве доказательства, экспериментальное облучение ультрафиолетовым излучением B (UVB 45-90 кДж/м -2) неповрежденной кожи собаки с поверхностной пузырчаткой в стадии ремиссии спустя сутки привело к эпидермальному акантолизу и развитию клинических проявлений. В опытах in vitro инкубация сыворотки c UVB-облученными эксплантатами кожи приводила к более интенсивному внутригранулярному акантолизу, чем необлученных культур клеток [14]. Интересно, что при эритематозной пузырчатке, светочувствительность не является пусковым механизмом.
Имеются данные, что у собак с аллергическими кожными заболеваниями в анамнезе, в частности, аллергическим блошиным дерматитом, чаще регистрируют листовидную пузырчатку. Тем не менее доказательств, подтверждающих взаимосвязь, не было дано, поэтому это наблюдение должно быть принято с осторожностью из-за высокой распространенности аллергических заболеваний в популяции собак и кошек в целом [22].
Листовидная пузырчатка у животных была зарегистрирована в связи с различными системными заболеваниями, такими как гипотиреоз [22], лейшманиоз, тимома [4], системная красная волчанка и лимфома [6]. Взаимосвязь между пузырчаткой и сопутствующими патологиями может быть случайной, или она может отражать системный процесс, ведущий к индукции иммунологических нарушений вследствие нарушений иммунного ответа.
Некоторые медикаменты могут способствовать «фармакологическому акантолизу» (т.е. медикаментозный пузырчатке), в то время как другие могут только вызывать клиническое проявление болезни у пациентов, уже предрасположенных к развитию пузырчатки [29]. Такими триггерами могут быть различные препараты, в том числе антибиотики, НПВС, местные противопаразитарные спот-оны [2, 20], вакцины и др.
Животным с листовидной пузырчаткой, как и с другими аутоиммунными болезнями, не рекомендуется дальнейшая вакцинация, которая посредством стимуляции обширного неспецифического иммунного ответа может способствовать рецидиву аутоиммунного заболевания [28]. В случае необходимости можно прервать только антирабическую вакцинацию или рассмотреть вопрос о ревакцинации с учетом риска и преимущества.
Клинические признаки
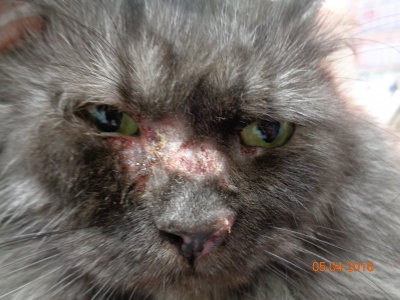
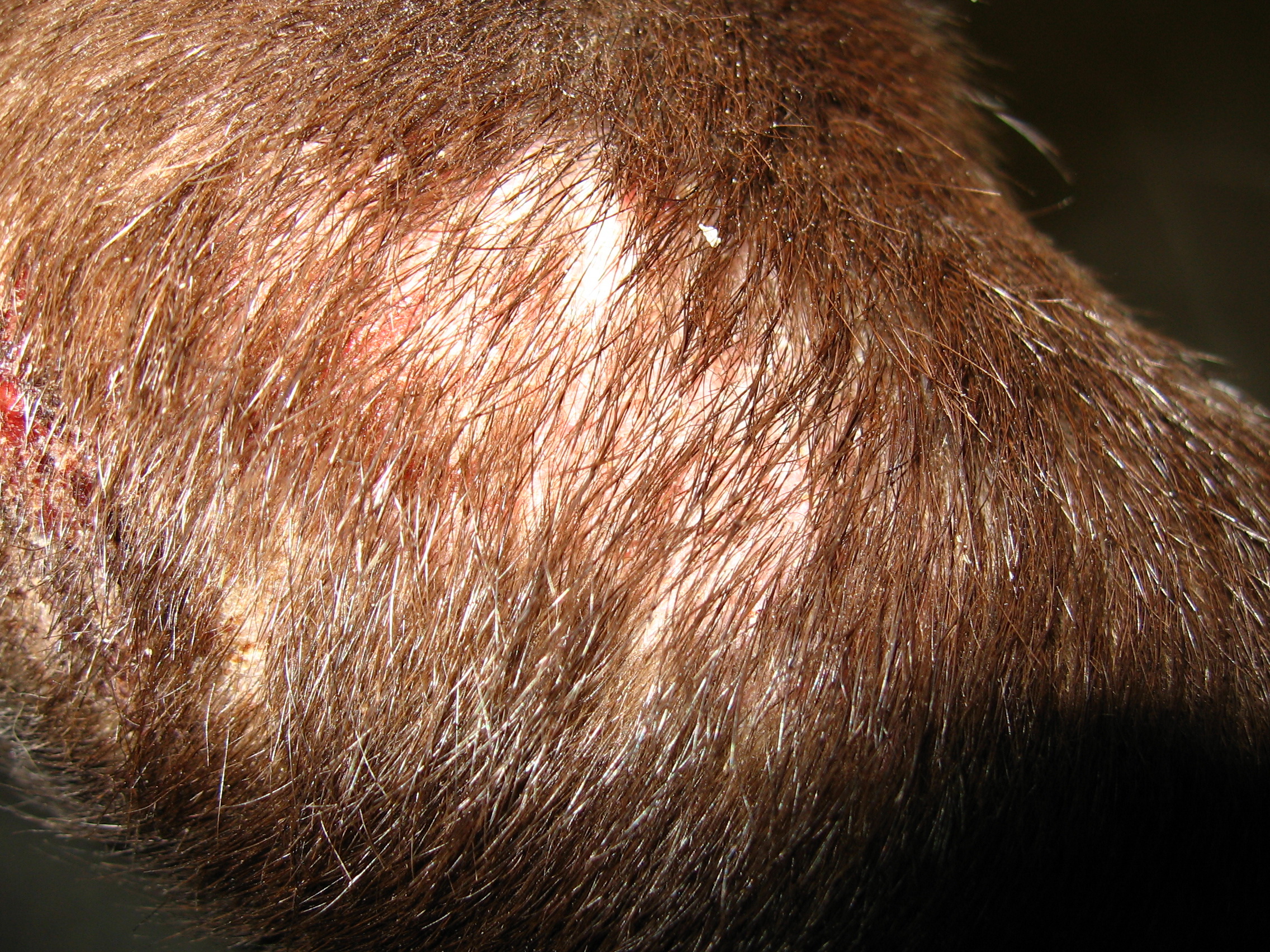
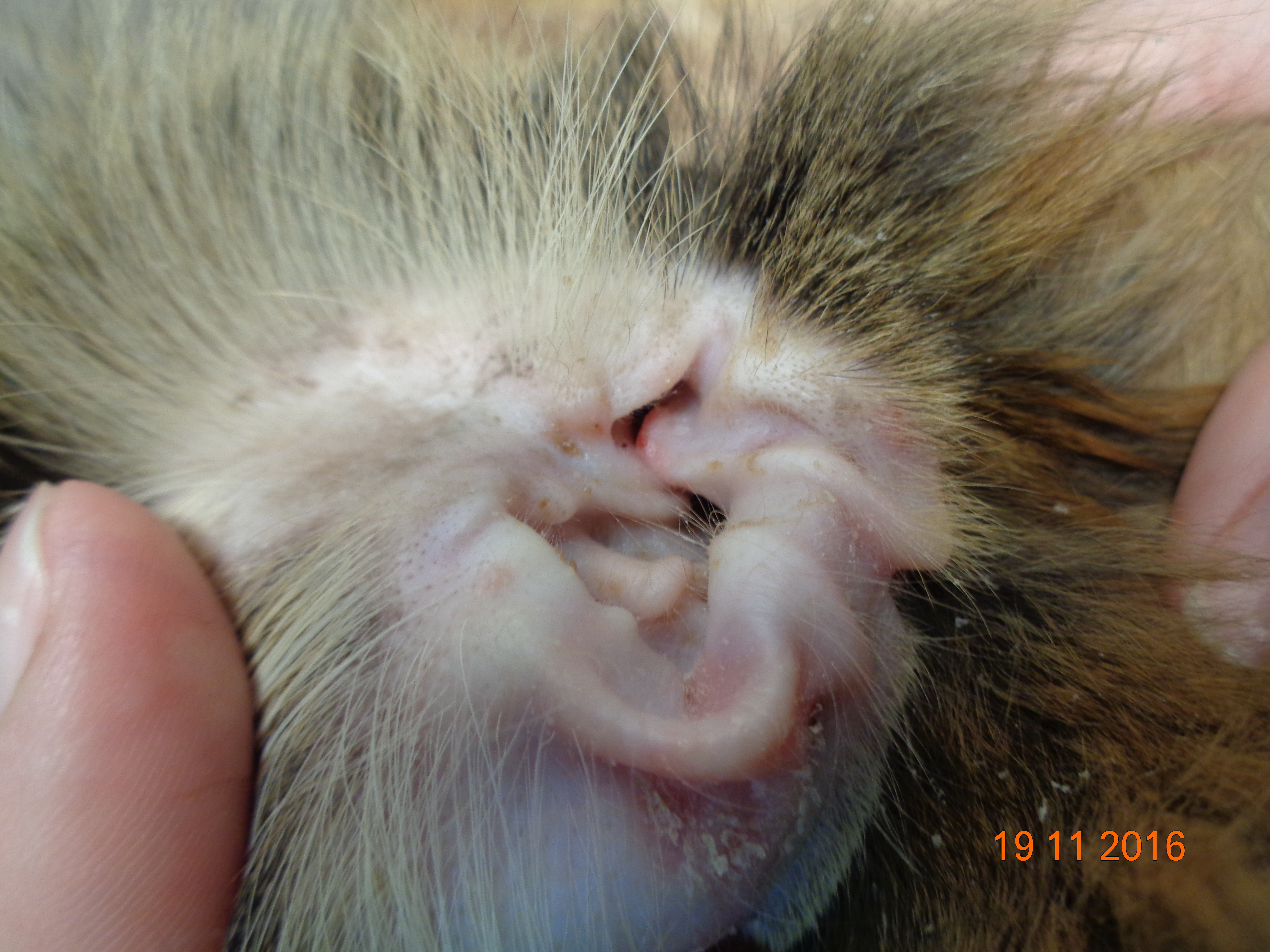
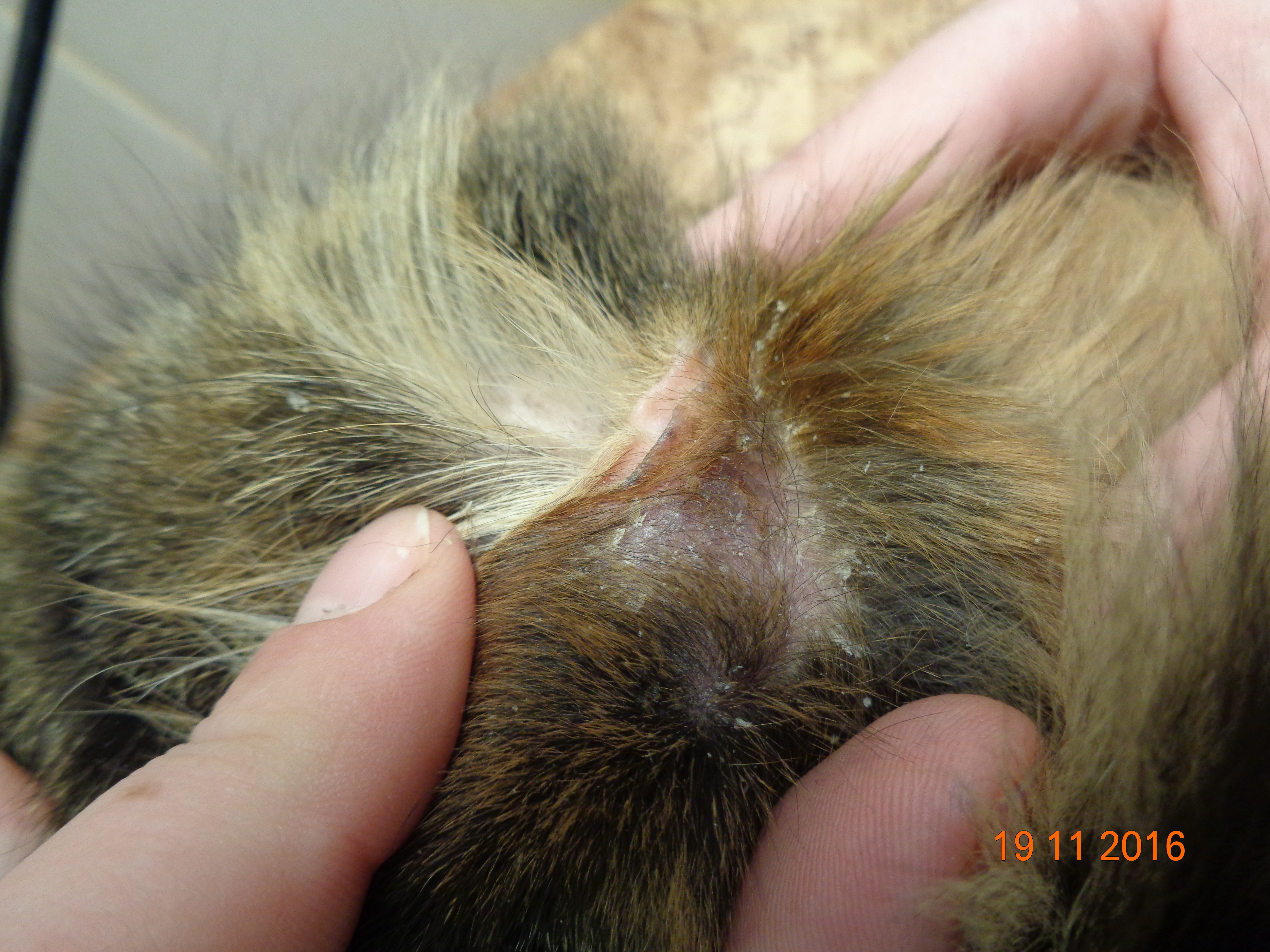
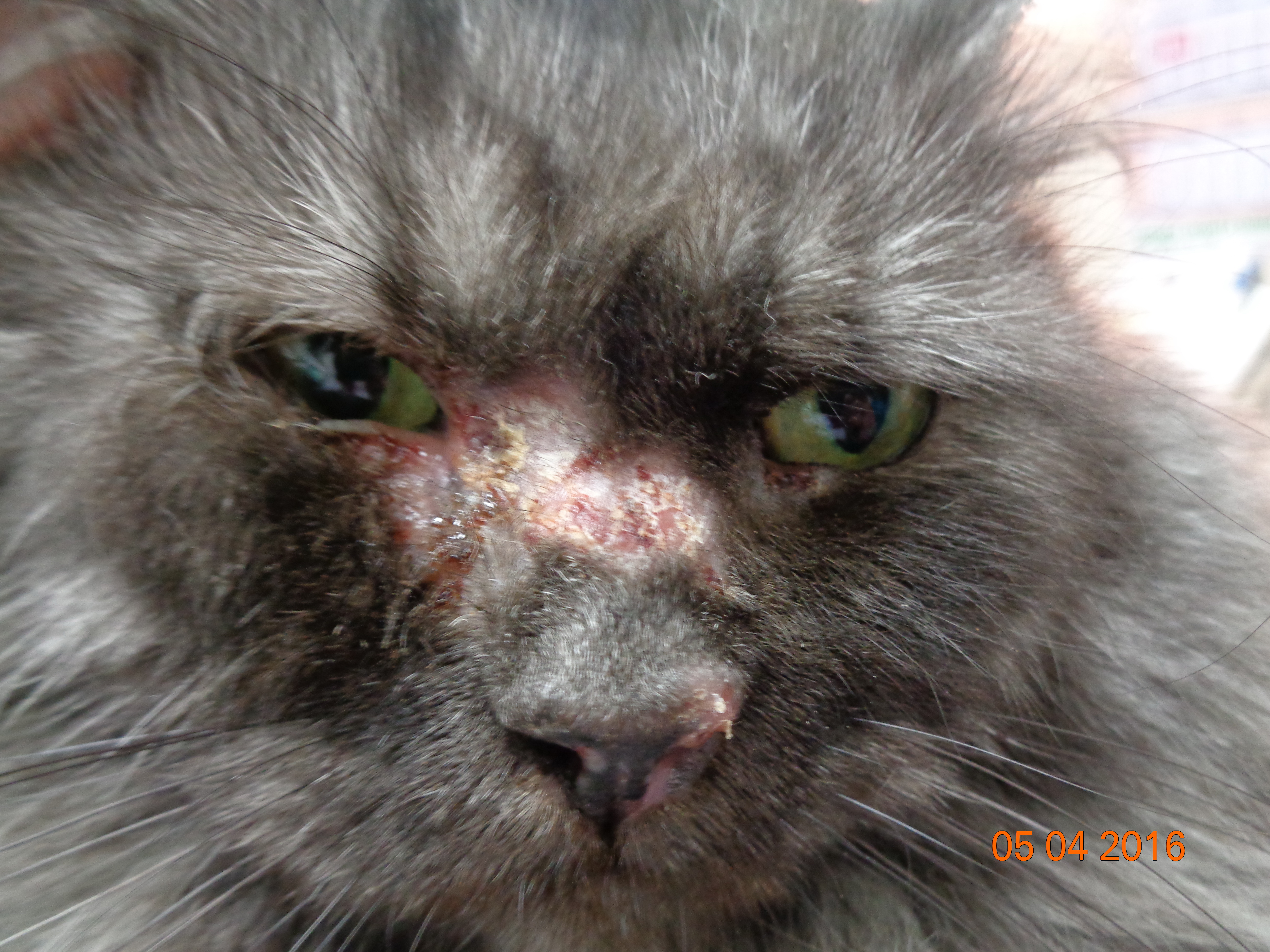
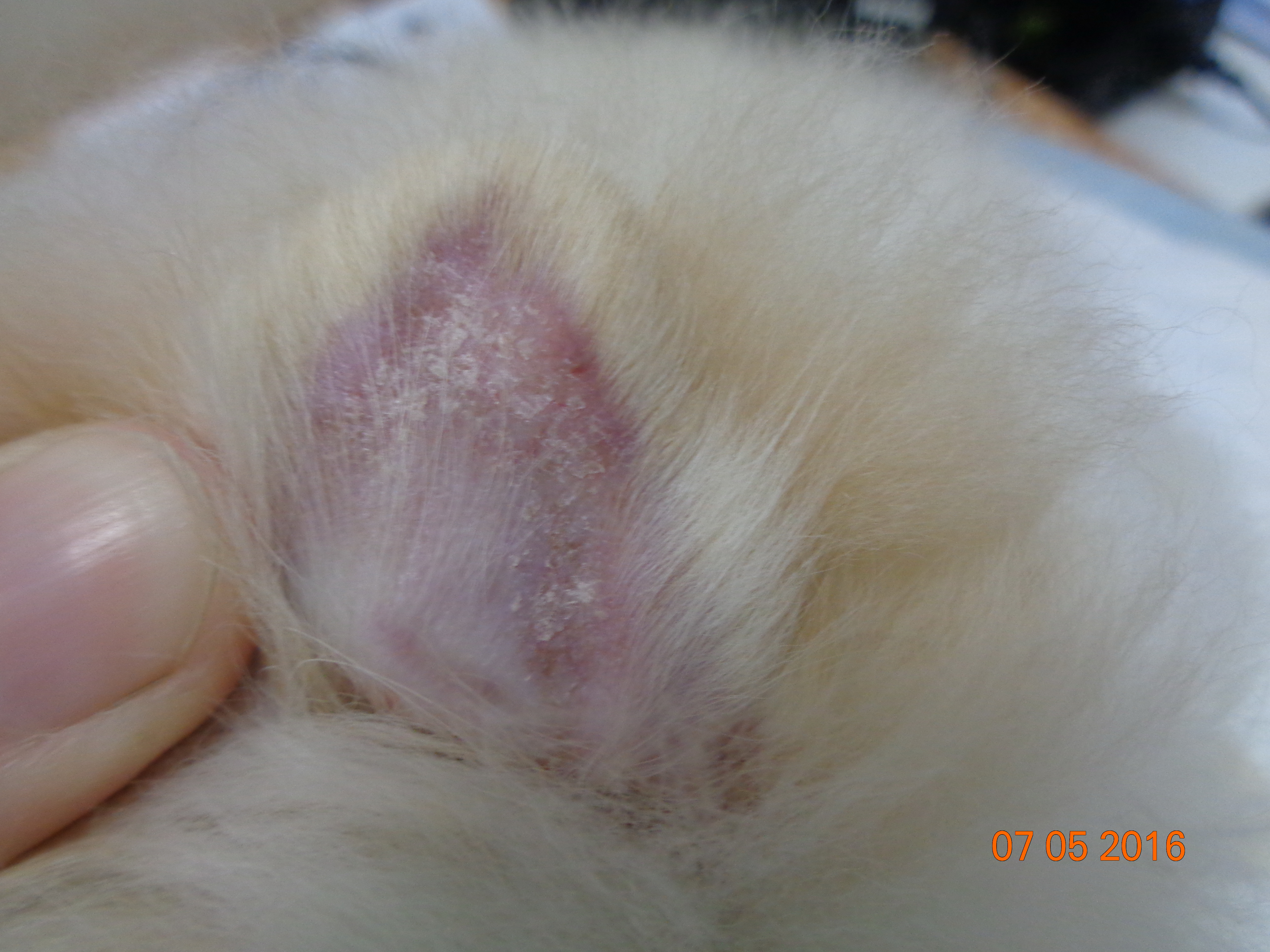
Клинические признаки листовидной пузырчатки сходны у всех видов домашних животных. Как правило, поражения появляются первоначально на морде, главным образом дорсально, мочке носа, ушных раковинах, вокруг глаз. Характерна симметричность поражений. Затем дерматоз распространяется на остальные части тела (в течение 3–12 месяцев). По данным одного ретроспективного исследования лишь у 16% собак поражения оставались локализованными. У трети собак поражаются подушечки лап, в то время как повреждения слизистой оболочки встречается редко (2/91 или 2%) [18]. Описан случай листовидной пузырчатки с локализованными поражениями только когтей [9].
Первичным поражением являются пятна, быстро прогрессирующие до пустул, которые могут быть крупными или даже сливающимися. Как правило, пустулы существуют недолго, поскольку быстро разрываются, подсохший экссудат превращается в корочки – наиболее частый клинический признак. Могут отмечаться эрозии, редко язвы, как правило, вследствие вторичного инфицирования [12, 17]. В редких случаях пустулы, эрозии и корочки группируются в уникальный кольцевой или полициклический узор, а при генерализованном поражении может развиться алопеция и эксфолиативная эритродермия. Пустула может охватывать несколько волосяных стержней, в то время как при бактериальном фолликулите характерны пустулы с одиночным стержнем волоса в центре [16]. Зуд присутствует у 25–50% собак с поверхностной пузырчаткой, в то время как системные симптомы (анорексия, депрессия, лихорадка и потеря веса), как правило, встречаются редко, преимущественно у собак с обширными эрозированными поражениями [22].
Клиническая картина листовидной пузырчатки у кошек аналогична проявлениям болезни у собак, пустулы существуют крайне непродолжительное время, преобладают эрозии и желтоватые корочки на морде, ушах и лапах, также могут наблюдаться гнойные поражения и корочки в области подушечек лап или кожной складки основания когтей. Генерализованные поражения встречаются редко.
Диагностика
Цитологическое исследование является первым диагностическим шагом при подозрении на листовидную пузырчатку, предпочтительно исследовать содержимое невскрывшейся пустулы. В цитологии характерно наличие большого числа недегенеративных нейтрофилов, некоторого количества эозинофилов и акантолитических кератиноцитов (крупные округлые клетки с центрально расположенным базофильным ядром и умеренно базофильной цитоплазмой, более интенсивно окрашенной по периферии клетки). Однако необходимо помнить, что акантолиз могут вызывать не только иммунные факторы, но и стафилококковые инфекции и дерматофиты, в частности Trichophyton spp., поэтому важно проводить цитологическое исследование, чтобы в случае выявления возбудителей инфекции назначить соответствующее лечение до проведения биопсии. При наличии фагоцитированных бактерий рекомендуется 4–6-недельный курс антибиотикотерапии, а в случае клинического выздоровления более вероятным диагнозом становится пиодермия кожно-слизистых зон, нежели пузырчатка.
«Золотой стандарт» диагностики аутоиммунных дерматозов – гистопатология. Однако информативность метода в значительной степени зависит от ряда моментов:
места, покрытые корочками, нельзя брить и тщательно тереть, поскольку в связи с локализацией патологического процесса в верхних слоях эпидермиса при удалении корочек зачастую теряется информативность материала;
на момент отбора проб на гистологическое исследование животное не должно получать кортикостероидов;
не стоит отбирать материал со дна язвенного поражения;
использование нескольких методов окраски, в том числе специальные, например, с Шифф-йодной кислотой (ШИК) для исключения дерматофитов.
Гистологическое исследование образцов кожи пациентов с листовидной пузырчаткой выявляет интраэпидермальные и субкорнеальные пустулы, содержащие нейтрофилы и различное число эозинофилов, а также акантолитические кератиноциты [8]. При листовидной пузырчатке пустулы могут поражать шиповатый и зернистые слои эпидермиса, проникать в просвет фолликулярной воронки, захватывая несколько фолликулов, что отличает поражения при пузырчатке от бактериального фолликулита. Микроскопические характеристики акантолитических кератиноцитов аналогичны наблюдаемым в цитологии. Клетки эпидермиса, недавно отсоединенные от соседних, могут иметь цитологические характеристики апоптоза. Даже если акантолитические кератиноциты можно увидеть в пустулах при бактериальных инфекциях и пустулезном дерматофитозе, наличие большого количества свободно «плавающих» клеток эпидермиса с признаками апоптоза, часто в виде кластеров, более характерно для пузырчатки, чем для инфекционных дерматозов [16]. Дифференциальная диагностика других видов пузырчатки, встречающихся значительно реже, представляет некоторые трудности. Так, поверхностные акантолитические эпидермальные пустулы наблюдаются при всех типах пузырчатки у собак, в то время как наличие лихеноидного, поверхностного плазмоцитарного или лимфоплазмоцитарного дерматита с или без повреждения базальных клеток при локализации поражений в области носа и морды характерно больше для эритематозной пузырчатки. При прямой иммунофлюоресценции образцов биоптатов кожи собак и кошек с эритематозной пузырчаткой наряду с межклеточными нарушениями в эпидермисе, характерными для всех заболеваний из группы пузырчатки, выявляют и осаждение иммуноглобулинов на базальной мембране, подобное системной волчанке [19]. При панэпидермальной пустулезной пузырчатке (Panepidermal pustular pemphigus) у собак обнаруживают акантолитические пустулы, скопления нейтрофилов и эозинофилов на всех слоях эпидермиса и в супрабазальном слое, в наружном эпителия воронки фолликула. Индивидуализация подхода в зависимости от типа пузырчатки зачастую затруднительна, поскольку клинические признаки, результаты гистологических и иммунологических исследований при болезнях из этой группы свидетельствуют о гетерогенности проявлений их у животных. Поэтому терминология "поверхностная пузырчатка" остается наиболее подходящим диагнозом, имея в виду однотипный подход к лечению и прогноз при всех болезнях группы пемфигус-комплекса [22].
Наличие антинуклеарных антител (ANA) в сыворотке крови собак нехарактерно для собак с листовидной пузырчаткой, в то время как низкие титры (1:10–1:40) были выявлены у примерно половины собак с эритематозной пузырчаткой.
Дополнительные методы диагностики могут включать посев на дерматофиты, иммунофлюоресцентный и иммуногистохимический анализ, а также исследование на эрлихиоз.
Диагноз
Пока дальнейшие исследования не позволяют провести уточнения в нозологии синдрома пузырчатки, диагноз основывается, главным образом, на клинико-патологических данных. Основными критериями диагностики стоит считать следующие.
1. Результаты клинического осмотра: пустулы, быстро переходящие в мелкие эрозии и корочки, преимущественно в области головы и лап.
2. Гистопатология: поверхностные эпидермальные или фолликулярные пустулы, содержащие недегенеративные нейтрофилы в большом количестве и акантолитические кератиноциты, часто группами.
3. Дифференциальный диагноз: исключение других акантолитических нейтрофильных гнойничковых болезней, особенно эксфолиативной стафилококковой пиодермии и пустулярного дерматофитоза.
Лечение и прогноз
На сегодняшний день применение иммуносупрессивных средств является методом выбора для лечения листовидной пузырчатки у домашних животных. Следует отметить, что все рекомендации по иммуносупрессивной терапии первоначально были основаны на принципах, используемых для лечения аутоиммунных болезней у человека, широкомасштабные клинические испытания на животных не проводились в связи в редкостью данной патологии, поэтому рекомендации по ведению животных с листовидной пузырчаткой основаны на ретроспективном анализе.
Курс лечения начинают со стадии индукции при помощи пероральных глюкокортикоидов, например, преднизолона, в суточных дозах от 2 до 6,6 мг/кг (в один или два приема) [25]. Как только поражения уменьшаются в размерах и степени тяжести, частота введения или доза глюкокортикоидов снижается с целью как можно более быстрого перехода на альтернативные дни (режим «через день»). Однако во многих случаях листовидной пузырчатки у собак глюкокортикоидная терапия в монорежиме не позволяет получить ремиссию или даже не может остановить прогрессирование поражений, в таких случаях обычно добавляют цитостатические препараты: азатиоприн (2–2,5 мг/кг, перорально, один раз в день), циклофосфамид (25 мг/м2, перорально, один раз в день) или хлорамбуцил (0,2 мг/кг каждые 24–48 ч) [25]. В качестве альтернативы несколько десятилетий назад для лечения собак с развитием неприемлемых побочных эффектов иммуносупрессивных препаратов была предложена иммуномодуляция при помощи инъекций ауротиоглюкозы (1 мг/кг раз в неделю) [25]. Наконец, некоторые собаки с листовидной пузырчаткой отвечают на тетрациклин и ниацинамид (по 250–500 мг каждого препарата, три раза в день) [19, 30]. Два небольших клинических исследования показали эффективность микофенолята для лечения собак с пузырчаткой. В экспериментальном исследовании, длившемся 16 недель, восемь собак получали микофенолята мофетил в суточной дозе 20–40 мг/кг в день, разделяя на три приема [3]. У трех собак (37%) было отмечено уменьшение площади и/или тяжести поражений, четыре собаки не завершили исследование и две были подвергнуты эвтаназии. Кроме того, все собаки получали сопутствующую терапию глюкокортикоидами для контроля тяжести поражений кожи. Таким образом, в результате высокой стоимости и ограниченной доказанной эффективности, в настоящее время имеется недостаточно доказательств для рекомендации этого препарата для лечения собак с листовидной пузырчаткой [3]. Небольшое исследование по использованию циклоспорина (5–10 мг/кг один раз в день) показало также низкую эффективность препарата при лечении собак с листовидной пузырчаткой (клинические улучшения лишь у одной из пяти собак) [21].
Прогноз при листовидной пузырчатке собак вариабелен, предположительно из-за различий в протоколах лечения и/или подтипах болезни. По данным ретроспективных исследований, ремиссия наступала у 53–88% собак, при этом смертность в течение первого года лечения составила до 60%, включая случаи эвтаназии из-за отсутствия ответа на терапию, низкого качества жизни или возникновения неприемлемых побочных эффектов лекарственных препаратов. Интересно отметить, что использование антибиотиков на начальном этапе иммуносупрессивной терапии значительно повышало выживаемость в этой группе пациентов [7]. По данным Ральфа Мюллера с соавт., (2006) полная ремиссия была достигнута у 15 из 39 собак (38%) в течение 1,5–12 месяцев после начала монотерапии глюкокортикоидами (в среднем 7 месяцев) и у 18 из 33 собак (55%) в течение 2–29 месяцев (в среднем 12 месяцев) на комбинированном лечении глюкокортикоидами и азатиоприном. Таким образом, добавление азатиоприна не оказывало существенного влияния на скорость наступления ремиссии, но в случаях, когда монотерапия преднизолоном была недостаточно эффективной, добавление азатиоприна приводило к клиническому выздоровлению [19]. Важно отметить, что тяжелые осложнения значительно чаще возникали в группе собак, получающих комбинацию преднизолон-азатиоприн, чем при монотерапии глюкокортикоидами. Эти данные указывают на то, что назначение азатиоприна рекомендовано только в случаях, когда использование одних стероидов не оказалось результативным. Кроме того, использование цитостатиков существенно повышает стоимость лечения в связи с необходимостью регулярного мониторинга.
Кортикостероидная монотерапия кошек с листовидной пузырчаткой обычно является эффективной для достижения клинической ремиссии. В большинстве случаев ремиссия наступает спустя 2 недели терапии, при этом общая суточная доза преднизолона на стадии индукции составляет 1,25–3 мг мг/кг/сутки. В случае недостаточного контроля кожных проявлений спустя 2 недели терапии доза преднизолона может быть увеличена до 4 мг/кг два раза в день [27]. В случаях недостаточного ответа кошек на преднизолон, может оказаться эффективным триамцинолон в дозе 0,6–2 мг/кг в сутки [24].Кошкам, не отвечающим на пероральные глюкокортикоиды, возможно назначение хлорамбуцила (0,2 мг/кг, перорально, один раз в день) [10, 24]. Азатиоприн, успешно использованный для лечения собак с листовидной пузырчаткой, противопоказан кошкам в связи с высоким риском развития необратимой глубокой нейтропении и тромбоцитопении. Видовая непереносимость азатиоприна у кошек связана с низкой активностью тиопуринметилтрансферазы, метаболизирующей азатиоприн [31].В одном ретроспективном исследовании полная ремиссия поражений наступила у 15 из 15 кошек (100%), получавших только триамцинолон, у восьми из 13 (62%) кошек, получавших только преднизолон, у девяти из 11 (82%) кошек на комбинированной терапии (преднизолон и хлорамбуцил). При этом более полная ремиссия и более редкие случаи развития побочных реакций были достигнуты у кошек, получавших триамцинолон. Только четыре из 30 кошек (13%) были подвергнуты эвтаназии из-за неподдающихся контролю кожных поражений или осложнений лечения [24].
После достижения клинической ремиссии дозу кортикостероидов снижают, по возможности, до полной отмены. При невозможности полной отмены терапии, средняя поддерживающая доза преднизолона составляет 1,2–1,8 мг/кг/неделю. К сожалению, случаи рецидивирования пузырчатки после отмены лечения достаточно часты, в одном ретроспективном обзоре у 68% кошек возникал рецидив заболевания после достижения полной ремиссии в течение 6 месяцев [27]. Альтернативой кортикостероидам могут быть циклоспорин и хлорамбуцил. Стартовая суточная доза циклоспорина составляет 4,4– 5,6 мг/кг ежедневно. Возможными побочными эффектами циклоспорина могут быть желудочно-кишечные нарушения (анорексия, рвота, диарея), возникающие в начале приема циклоспорина. В большинстве случаев эти явления проходят без дополнительного вмешательства. При непереносимости или отсутствии эффекта от терапии кошкам с пузырчаткой можно назначить иммуносупрессивную терапию с использованием хлорамбуцила (перорально в дозе 0,2 мг/кг ежедневно или через день). Побочные эффекты хлорамбуцила включают анорексию, потерю веся и лейкопению. В тяжелых, рефрактерных к терапии случаях листовидной пузырчатки у кошек используется комбинированная терапия – циклоспорин (4,4–6,7 мг/кг ежедневно или 2–3 раза в неделю) или хлорамбуцил (0,17–0,38 мг/кг 2–3 раза в неделю) и кортикостероиды (преднизолон 2–3,1 мг/кг или дексаметазон 0,13–0,2 мг/кг). Имеются данные об эффективном использовании комбинации дексаметазона (0,1 мг/кг дважды в неделю), циклоспорина (7,4 мг/кг ежедневно) и хлорамбуцила (0,2 мг/кг через день) у кошки, в течение полугода не поддающейся терапии этими препаратами по отдельности [13].
Сопутствующая терапия включает антимикробные средства и местную терапию. В случае обнаружения бактериальной инфекции при цитологическом исследовании обосновано назначение антибиотиков. Местные кортикостероиды, например, крем с 0,1% бетаметазоном или спрей с 0,015% триамцинолоном, могут быть использованы в начале лечения и при рецидиве кожных поражений [13].
Одной из возможных причин резистентности к лечению является эмоциональный стресс; это было описано у людей с пузырчаткой, в качестве дополнительной терапии получающих анксиолитические препараты [19], но не было исследовано у животных [11, 27].
Литература
1. Bizikova P., Deanb G.A., Hashimotoc T., Olivry Th.Cloning and establishment of canine desmocollin-1 as a major autoantigen in canine pemphigus foliaceus // Veterinary Immunology and Immunopathology. 2012; 149, 3–4 (15): 197–207.
2. Bizikova P., Linder K.E., Olivry T. Fipronil-amitraz-S-methoprene-triggered pemphigus foliaceus in 21 dogs: clinical, histological and immunological characteristics // Veterinary Dermatology. 2014; 25(2): 103−111.
3. Byrne K.P., Morris D.O. Study to determine the usefulness of mycophenolate mofetil for the treatment of pemphigus foliaceus in dogs (Abstract) // Veterinary Dermatology. 2001; 12: 226.
4. Day M.J. Review of thymic pathology in 30 cats and 36 dogs // Journal of Small Animal Practice. 1997; 38: 393–403.
5. Fassihi H., Wong T., Wessagowit V., et al. Target proteins in inherited and acquired blistering skin disorders // Clinical and Experimental Dermatology. 2006; 31: 252–259.
6. Foster A.P., Sturgess C.P., Gould D.J., et al. Pemphigus foliaceus in association with systemic lupus erythematosus, and subsequent lymphoma in a cocker spaniel // Journal of Small Animal Practice. 2000; 41: 266–270.
7. Gomez S.M., Morris D.O., Rosenbaum M.R., et al. Outcome and complications associated with treatment of pemphigus foliaceus in dogs: 43 cases (1994–2000) // Journal of the Veterinary Medical Association. 2002; 224: 1312–1326.
8. Gross T.L., Ihrke P.E., Walder E.J., et al. Skin diseases of the dog and cat, 2nd. Ames, Iowa: Blackwell, 2005: 65–68.
9. Guaguere E., Degorce-Rubiales F. Pemphigus foliaceus confined to the nails in a Hungarian short-haired pointer (Abstract) // Veterinary Dermatology. 2004; 15 (1): 56.
10. Helton-Rhodes K., Shoulberg N. Chlorambucil: effective therapeutic options for the treatment of feline immune-mediated dermatoses // Feline Practice. 1992; 20: 5–8.
11. Hill P.B., Brain Ph., Collins D., Fearnside S., Olivry Th. Putative paraneoplastic pemphigus and myasthenia gravis in a cat with a lymphocytic thymoma // Veterinary Dermatology. 2013; 24 (6): 646–652.
12. Ihrke P.J., Stannard A.A., Ardans A.A. et al. Pemphigus foliaceus in dogs: a review of 37 cases // Journal of the American Veterinary Medical Association. 1985; 186: 59–66.
13. Irwin K.E., Beale K.M., Fadok V.A. Use of modified ciclosporin in the management of feline pemphigus foliaceus: a retrospective analysis //Veterinary Dermatology. 2012; 23 (5): 403–407.
14. Iwasaki T., Maeda Y. The effect of ultraviolet (UV) on the severity of canine pemphigus erythematosus (Abstract) // Proceedings of the American Academy of Veterinary Dermatology and American College of Veterinary Dermatology Annual Meeting Annual Meeting. Nashville, TN: American Academy of Veterinary Dermatology, 1997: 86.
15. Iwasaki T., Yamakita-Yoshida K. Time course of autoantibodies and clinical signs in canine pemphigus foliaceus (Abstract) // Proceedings of the American Academy of Veterinary Dermatology and American College of Veterinary Dermatology Annual Meeting. Monterey, CA: American Academy of Veterinary Dermatology, 2003: 240.
16. Kuhl K.A., Shofer F.S., Goldschmidt M.H. Comparative histopathology of pemphigus foliaceus and superficial folliculitis in the dog // Veterinary Pathology. 1994; 31: 19-27.
17. Miller W.H., Griffin C.E., Campbell K.L. Muller and Kirk’s Small Animal Dermatology, 7th ed. St. Louis: MO Saunders,2013: 439–500.
18. Mueller R.S., Krebs I., Power H.T., Fieseler K.V. Pemphigus foliaceus in 91 dogs // J. Am. Anim. Hosp. Assoc. 2006; 42: 189–192.
19. Morell-Dubois S., Carpentier O., Cottencin O.,et al. Stressful life events and pemphigus // Dermatology. 2008; 216: 104–108.
20. Oberkirchner U. et al. Metaflumizone-amitraz (Promeris)-associated pustular acantholytic dermatitis in 22 dogs: evidence suggests contact drug-triggered pemphigus foliaceus // Veterinary Dermatology. 2011; 22(5): 436–448.
21. Olivry Th., Rivierre C., Murphy K.M. Efficacy of cyclosporine for treatment induction of canine pemphigus foliaceus // Veterinary Record. 2003; 152: 53–64.
22. OlivryTh.. A review of autoimmune skin diseases in domestic animals: I – Superficial pemphigus // Veterinary dermatology. 2006; 17 (5): 291–305.
23. Olivry Th.., La Voy A., Dunston S.M., Brown R.S., Lennon E.M., Warren S.J., Prisayanh P., Muller E.J., Suter M.M., Dean G.A. Desmoglein-1 is a minor autoantigen in dogs with pemphigus foliaceus // Vet. Immunol. Immunopathol. 2006; 110: 245–255.
24. Preziosi D.E., Goldschmidt M.H., Greek J.S., et al. Feline pemphigus foliaceus: a retrospective analysis of 57 cases // Veterinary Dermatology. 2003; 14: 313–321.
25. Rosenkrantz W.S. Pemphigus: current therapy // Veterinary Dermatology. 2004; 15: 90–98.
26. Scott D.W., Walton D.K., Slater M.R. et al. Immune-mediated dermatoses in domestic animals: ten years after – Part I. // Compendium on Continuing Education for the Practicing Veterinarian. 1987; 9: 424–435.
27. Simpson D. L., Burton G.G. Use of prednisolone as monotherapy in the treatment of feline pemphigus foliaceus: a retrospective study of 37 cats // Veterinary Dermatology. 2013; 24 (6): 598–601.
28. Westra J., Rondaan C., van Assen S., et al. Vaccination of patients with autoimmune inflammatory rheumatic diseases // National Review Rheumatology. 2015; 11(3): 135–145.
29. White S.D., Carlotti D.N., Pin D., et al. Putative drug-related pemphigus foliaceus in four dogs // Veterinary Dermatology. 2002; 13: 195–202.
30. White S.D., Rosychuk R.A.W., Reinke S.I., et al. Use of tetracycline and niacinamide for treatment of autoimmune skin disease in 31 dogs // Journal of the American Veterinary Medical Association .1992: 200.
31. White S.D., Rosychuk R.A.W., Outerbridge C.A. et al. Thiopurine methyltransferase in red blood cells of dogs, cats, and horses // Journal of Veterinary Internal Medicine. 2000; 14: 499–502.





Назад в раздел


















