Грибы рода Malassezia в заболеваниях животных / Fungi of genus malassezia in animal diseases
Еще фото
Автор (ы): Р.С. Овчинников, М.Г. Маноян, А. Г. Гайнуллина, П.П. Ершов/R.S. Ovchinnikov, M.G. Manoyan, A.G. Gaynullina, P.P. Ershov
Организация(и): ФГБУ «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ») / All-Russian State Research Institute of Control, Standardization and Certification of Veterinary Preparations
Журнал: №3 - 2013
УДК 619:616.992.28 В
Окончание. Начало в №1-2013
Ключевые слова: ветеринарная микология, микозы животных, дерматомикозы, Malassezia-отиты, Malassezia-дерматиты, малассезиозы, патогенные грибы, дрожжи, антимикотики
Key words: veterinary mycology, animal mycoses, dermatomycosis, Malassezia-otitis, Malassezia-dermatitis, malasseziozis, pathogenic fungi, yeasts, antifungal agents
Аннотация
Заболевания животных, в патогенезе которых участвуют грибы рода Malassezia, в настоящее время представляют важную проблему ветеринарной медицины. В данном обзоре обобщены современные литературные данные и результаты собственных исследований в области Malassezia-ассоциированных заболеваний. Охарактеризованы основные клинические формы – Malassezia-отиты, Malassezia-дерматиты и их предикторы. Детально рассмотрены методы диагностики малассезиозов, включая цитологические и культуральные. Показаны преимущества комплексного микробиологического исследования как наиболее достоверного и информативного при диагностике кожных инфекций животных. Рассмотрены общие подходы к терапии Malassezia-отитов и Malassezia-дерматитов, имеющиеся в арсенале противогрибковые препараты и различные схемы лечения. Обсуждена перспектива применения противогрибковых веществ растительного происхождения.
Summary
Fungi of genus Malassezia play a role in pathogenesis of several animal diseases and represent a significant problem of veterinary medicine. In current review the actual published data and our own experience on Malassezia-associated diseases are summarized. Main clinical forms (Malassezia-otitis and Malassezia-dermatitis) and their predictors are characterized. Diagnostic methods including cytological and cultural are detailed. Complex microbiological examination is shown to be the most reliable and comprehensive method in diagnosis of animal skin infections. General approaches to the therapy of Malassezia-otitis and Malassezia-dermatitis as well as available antifungals and applicable treatment protocols are reviewed. The perspective of antifungals of plant origin is discussed.
Как было показано в первой части данной статьи, грибы рода Malassezia обладают комплексом факторов вирулентности, которые позволяют им осуществлять адгезию и инвазию поверхностных тканей организма животных. Но при этом патогенность малассезий носит оппортунистический характер – они не способны самостоятельно вызвать заболевание в иммунокомпетентном организме. Таким образом, все Malassezia-ассоциированные заболевания развиваются на фоне предрасполагающих факторов, каких-либо уже имеющихся в организме нарушений. Также малассезии могут выступать как вторичные патогены, присоединяясь к уже имеющейся инфекции. Эти обстоятельства оказывают влияние и на клиническую манифестацию, и на подходы к диагностике и терапии Malassezia-инфекций.
Клинические формы Malassezia-инфекций
Малассезиозы могут локализоваться практически на любых участках кожи, однако наиболее часто поражается наружный слуховой канал. Такая клиническая форма известна как Malassezia-отиты. Malassezia-инфекции кожи в других локусах рассматриваются под общим термином Malassezia-дерматиты. Прежде чем подробно рассмотреть эти наиболее распространенные формы малассезиозов, необходимо отметить, что возбудитель может локализоваться и в других тканях организма, помимо кожи. Заболевания когтей (паронихии), вызываемые Malassezia spp., диагностируют как у собак, так и у кошек, в особенности породы девон-рекс. Поражения сопровождаются зудом конечностей, вязкими красно-коричневыми истечениями [1]. Prado, Brito [2] сообщают, что у 23% собак с язвой роговицы в очаге поражения обнаруживались грибы рода Malassezia. В то же время с роговицы здоровых животных дрожжи были выделены только в 3% случаев, что указывает на клиническую роль Malassezia spp. при глазных патологиях.
Имеются сообщения о роли M. pachydermatis при патологиях ротовой полости собак (стоматиты, фарингиты, тонзиллиты) [3].
О. Ивченко [4] также приводит случаи диагностирования нетипичных Malassezia-инфекций у собак и кошек – стоматиты, конъюнктивиты, риниты. Кроме того, автор диагностировал вулвовагиниты, акропоститы, поститы, баланопоститы с участием грибов рода Malassezia, которые по клиническим признакам мало отличались от таковых бактериальной этиологии. Данные патологии обычно вызывались ассоциацией дрожжей и бактерий. Клинически отмечали слизистые выделения, беспокойство животных (чрезмерное вылизывание пораженных участков), вызываемое зудом.
В нашей лабораторной практике был диагностирован случай инфекции зева у волнистого попугая, вызванной ассоциацией Malassezia pachydermatis и Klebsiella pneumoniae. Приведенные данные свидетельствуют, что грибы рода Malassezia не являются исключительно кожными патогенами, а могут поражать различные органы и ткани.
Malassezia-отиты
В настоящее время наружные отиты являются одной из самых распространенных патологий среди собак и кошек. Частота обращений к ветеринару по поводу отитов составляет 10-20% (от всех патологий) для собак и 2-10% для кошек (P. Ginel et al.) [5]. В регионах с тропическим климатом этот показатель среди собак достигает 40% (J. August, 1988). Авторы отмечают тенденцию к росту заболеваемости отитами. Так, в Японии в 1993 г. отиты регистрировались у 4,4% собак, а в 1997 г. уже у 8,1% (O. Kumai, 1998).
По данным P. Bourdeau (6), наружный отит в 40% случаев обнаруживают как сопутствующее заболевание при других дерматологических заболеваниях. Первичными причинами развития наружных отитов обычно являются эктопаразиты (ок. 10% у собак и до 70% у кошек); атопия (86%), кормовая аллергия (до 50%), контактный дерматит, эндокринные и аутоиммунные заболевания. К развитию наружных отитов предрасполагают сквозняки, купание животных, инородные тела в слуховом канале. И хотя грибы рода Malassezia не являются первичным фактором развития отита, вызываемые ими последствия могут быть серьезнее, чем от первичных патогенетических факторов, что обуславливает необходимость этиотропной терапии.
Выделяют несколько клинических форм наружных отитов. Эритематозный отит сопровождается эритемой, отеком, экссудацией, степень зуда варьирует. Эритематозно-церуминозный проявляется эритемой, обильным выделением ушной серы, зудом. Церуминозный отит характеризуется обильным выделением ушной серы, однако без признаков воспаления. Пролиферативная форма характеризуется гипреплазией сальных желез, образованием папул, сливающихся в форме «цветной капусты» в хронических случаях. Гнойная форма отитов характеризуется обильными гнойными истечениями.
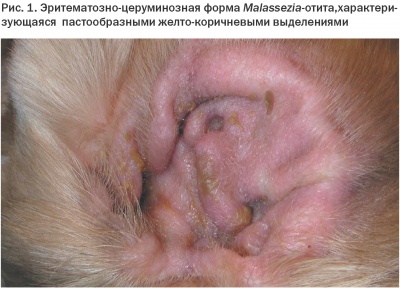
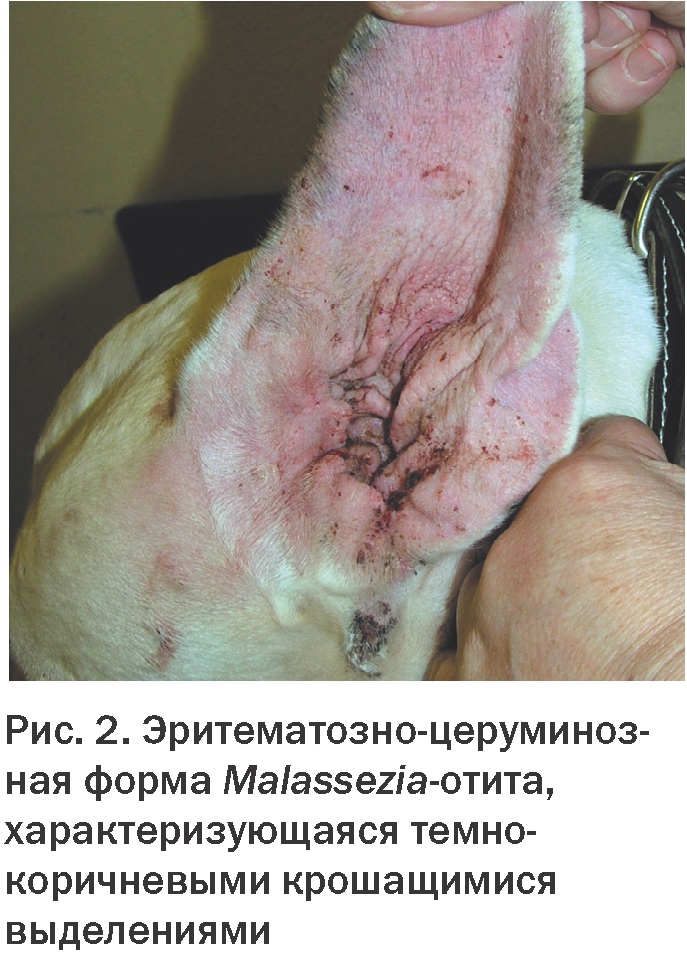
По наблюдениям P. Bourdeau [6], при Malassezia-отитах преобладает эритематозно-церуминозная форма (ок. 60%). В наших собственных исследованиях [7] эта клиническая форма также была доминирующей (85,2%). При этом отмечена разнородность выделяемого секрета по цвету и консистенции.
В ряде случаев наблюдали образование желтого или светло-коричневого секрета, с воскоподобной, мажущейся консистенцией (Рис. 1). Ушной секрет второго типа характеризовался темно-коричневым или черным цветом, обладал сухой, крошащейся консистенцией (Рис. 2).
При Malassezia-отитах в патологический процесс может быть вовлечено как одно, так и оба уха. По нашим наблюдениям в большинстве случаев (63,5%) у животных поражаются оба уха (двухсторонние отиты). Односторонняя локализация наблюдается в 22,6% случаев, а в 13,9% при односторонних отитах при дальнейших клинических наблюдениях отмечали распространение патологического процесса на второе ухо.
Л. Федоров [8] выделяет несколько степеней тяжести Malassezia-отитов у собак, в зависимости интенсивности признаков воспаления и гиперкератоза. При незначительной дрожжевой колонизации не отмечается никаких системных проявлений заболевания, внутренняя поверхность слухового канала несколько покрасневшая, при отоцитологическом исследовании обнаруживается суховатый, крошковатый или воскоподобный налет. По мере утяжеления воспалительного процесса отек кожи увеличивается, эритема становится все более выраженной. На поверхности кожи появляются пустулы, которые быстро вскрываются и покрываются корочками. Если же процесс носит сливной характер, внутренняя поверхность уха превращается в сплошную сочащуюся поверхность, в этом случае в мазке всегда присутствует значительная обсемененность малассезиями, выражена нейтрофильная экссудация, много фибрина и тканевого детрита. При хронизации процесса происходит лихенизация кожи наружного слухового канала, а цвет кожи приобретает своеобразный синеватый оттенок. Несмотря на то, что процесс затухает, в цитологическом мазке в большом количестве определяются ороговевшие клетки, как правило, всегда присутствуют лейкоциты и большое количество малассезий.
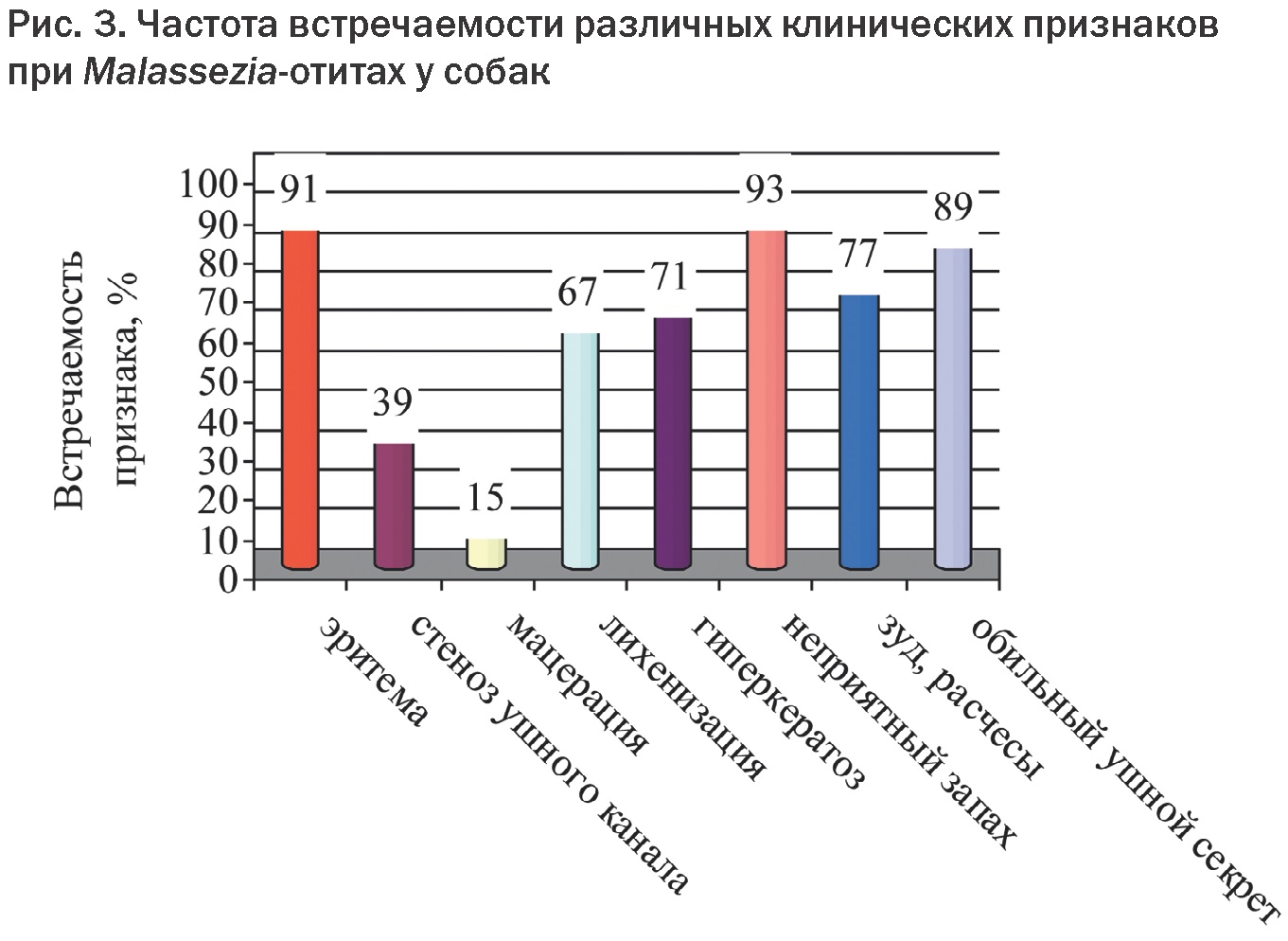
В наших собственных исследованиях мы проанализировали частоту встречаемости различных клинических признаков при Malassezia-отитах, полученные данные представлены на рис. 3.
Наиболее типичная клиническая картина Malassezia-отита характеризовалась эритемой, обильным выделением ушного секрета, зудом и расчесами, специфическим неприятным запахом. Также часто наблюдали гиперкератоз, лихенизацию кожи ушных раковин и устья слухового канала – признаки, характерные для хронических воспалительных процессов.
Характерной особенностью Malassezia-отитов является хроническое течение. Во всех наблюдавшихся нами случаях длительность заболевания составляла не менее 1 месяца и могла достигать 3 и более лет.
В большинстве случаев (75%) владельцы животных обращались за ветеринарной помощью, когда клинические признаки отита наблюдались уже в течение 1-3 лет. Самый длительный срок заболевания, зарегистрированный в наших исследованиях – 5 лет и 3 месяца. Как правило, заболевание носит персистирующий характер, с периодическими улучшениями и обострениями.
Без должного лечения могут наблюдаться осложнения наружного отита, такие как ушная гематома, травмы ушной раковины, кальцификация фиброзной ткани, абсцесс околоушного пространства, повреждения барабанной перепонки (гиперплазия, утолщение, растяжение), переход наружного в средний отит.
Malassezia-дерматиты
Этой форме малассезиозов подвержены в основном собаки, у кошек и других видов животных она встречается в единичных случаях. По нашим данным, Malassezia-дерматиты составляют 15% от всех кожных поражений у собак, подозреваемых на инфекционные заболевания.
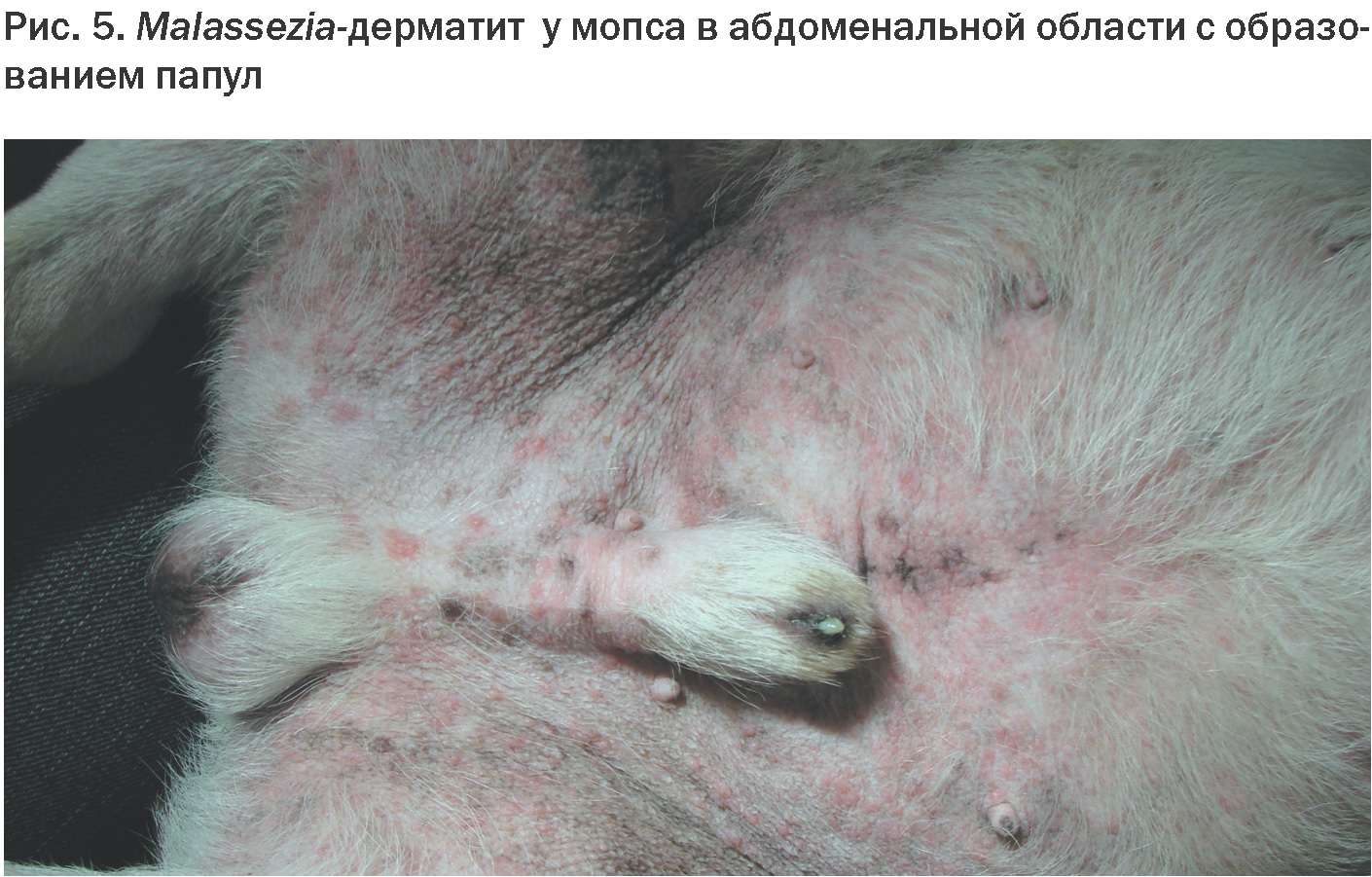
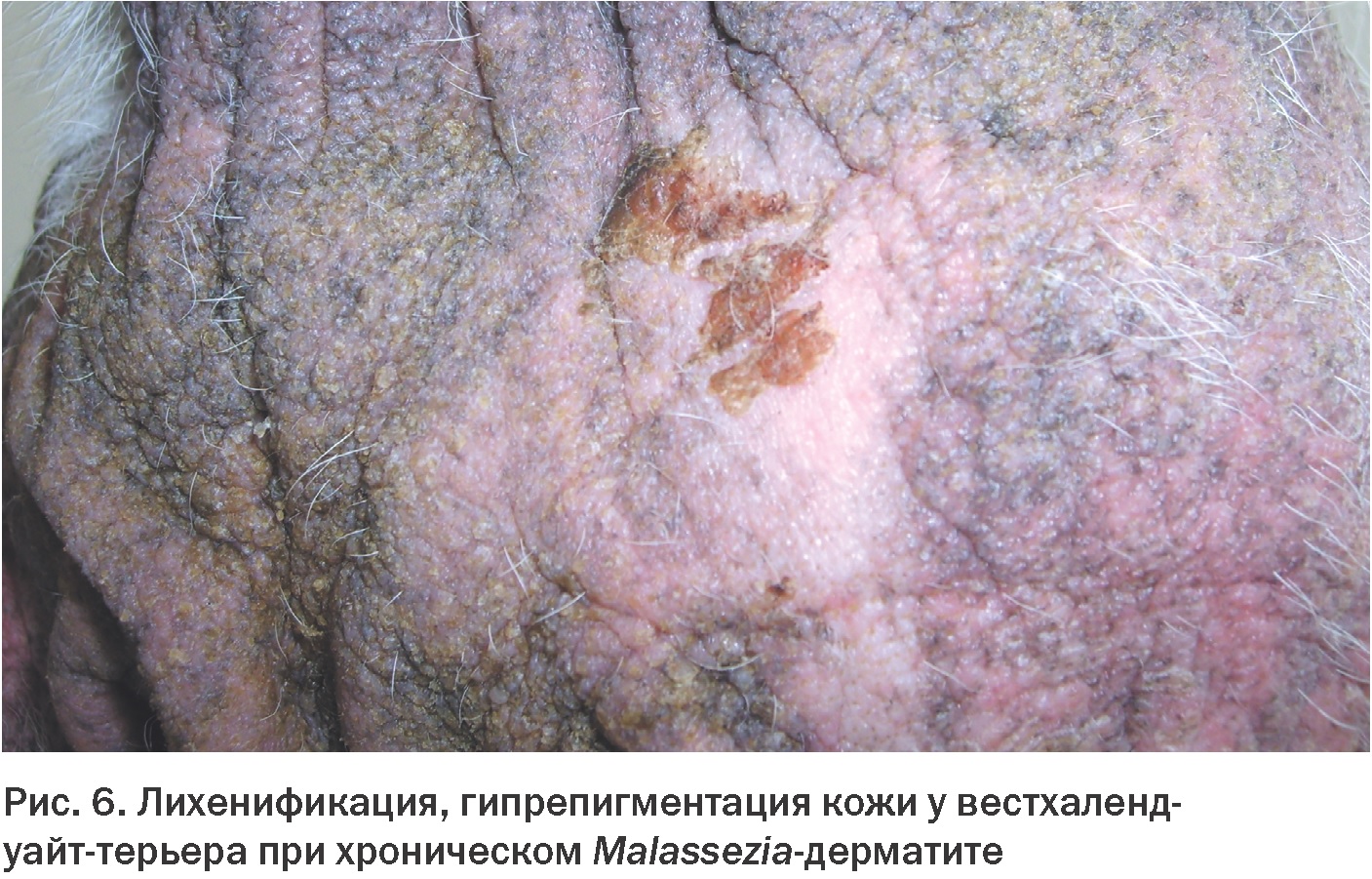
Для Malassezia-дерматитов характерны эритема, жироподобные выделения, алопеции, мацерация, образование комедонов (Рис. 4), папул (Рис. 5), в хронических случаях наблюдается гиперпигментация и лихенификация (Рис. 6). Могут наблюдаться папуловезику-локрустозные формы Malassezia-дерматитов с последующим развитием гнойного поражения кожи [8].
Malassezia-дерматиты клинически могут выглядеть как атопия, пищевая аллергия, демодекоз, что значительно осложняет диагностику. В ряде случаев наблюдают образование корочек и струпьев, напоминающих дерматофитоз. E. Mauldin et al. [9] обнаружили Malassezia spp. в кожных биоптатах от 11 кошек, проявлявших единичные и генерализованные кожные поражения в форме паранеопластических алопеций, тимома-ассоциированных дерматозов и мультифокальных эритем. N. McEwan [10] выделил культуры Malassezia spp. в ассоциации с Candida spp. от 12 бультерьеров, больных летальным акродерматитом (ЛАД).
Поражения кожи могут быть как единичные, так и множественные, распространяющиеся на различные участки тела.
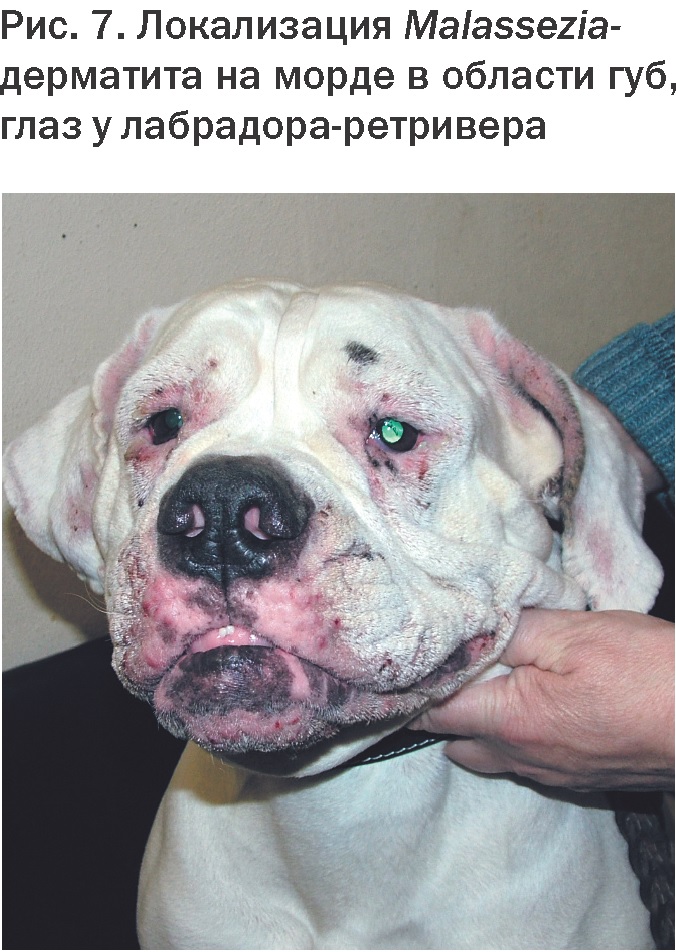
Malassezia-дерматиты обычно локализуются на вентральной поверхности тела (в области паха, брюшины) (Рис. 4, 5), на морде в области губ (Рис. 7), в области свода стопы и межпальцевых пространствах. Дистальные участки конечностей у собак более предрасположены к воспалительным заболеваниям, в т.ч. Malassezia-дерматитам, в связи с постоянным контактом этих частей тела с поверхностью почвы, их травматизацией, мацерацией и загрязнением [8].
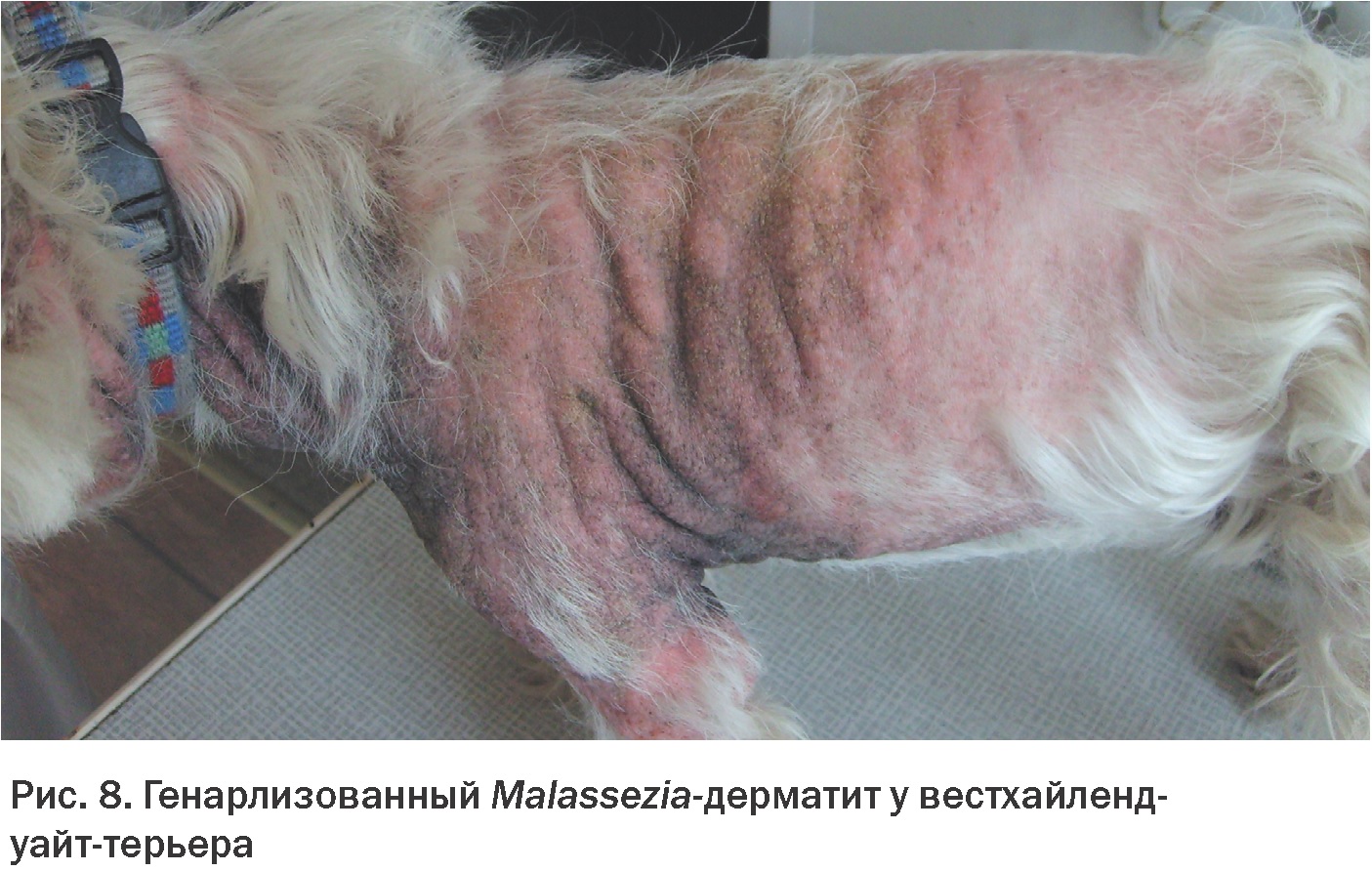
В некоторых случаях Malassezia-дерматиты носят генерализованный характер и распространяются практически на всю поверхность тела. Такая форма особенно характерна для вестхайленд-уайт-терьеров (Рис. 8).
Как и при Malassezia-отитах, при дерматитах нередко наблюдается зуд, особенно сильный при локализации в межпальцевых пространствах – в этих случаях животные интенсивно вылизывают и покусывают больные лапы.
Диагностика Malassezia-инфекций
Диагностика включает в себя сбор анамнеза, клиническое исследование, микробиологическое исследование, дифференциальный диагноз. При сборе анамнеза особое внимание следует уделить выявлению предрасполагающих факторов – первичных заболеваний, неблагоприятных воздействий и т.д., которые подробно рассматривались в первой части настоящей статьи. Выявление и устранение этих факторов – залог успешного лечения малассезиозов. Следует обратить внимание на длительность патологического процесса, динамику его распространения.
При диагностике наружных отитов клиническое обследование включает осмотр ушной раковины, при котором отмечают изменения кожи (утолщение, язвы, отеки). Проводят пальпацию околоушной области, отмечая болезненность, флуктуацию. Обследуют обязательно оба уха.
Важную роль играет отоскопическое исследование. Перед ним важно провести чистку ушного канала от серы, чтобы обнаружить патологические изменения, такие как стеноз, складки, травмы канала. Однако ввиду болезненности провести отоскопическое исследование удается не всегда даже при седации животного. В таких случаях необходим предварительный противовоспалительный курс, чтобы устранить стеноз ушного канала.
По мнению С. Вильгельм [11], предпочтительно использовать видеоотоскоп, т.к. он дает более интенсивное освещение и обеспечивает большее увеличение. Кроме того, с его помощью легче визуализировать барабанную перепонку. Даже если отит является односторонним, следует проверить оба уха, начиная с менее пораженного. Ушную раковину надо достаточно сильно оттянуть, а затем обследовать вертикальный и горизонтальный проход. P. Bourdeau [6] рекомендует проводить отоскопическое исследование у всех животных, поступающих на приём к дерматологу, независимо от того, имеются ли жалобы на проблемы с ушами.
Важную роль играет дифференциальная диагностика, т.к. клинически Malassezia-инфекции могут напоминать аллергические реакции, атопии, стафилококковые инфекции, демодекоз, дерматофитоз, чесотку, эпителиотрофические новообразования. Однако диагностика осложняется тем, что все эти заболевания могут протекать одновременно с Malassezia-инфекцией [12]. Определяющим диагностическим тестом является микробиологическое исследование, позволяющее оценить микробный пейзаж в очаге поражения, выявить наличие грибов рода и других инфекционных агентов.
Микробиологические методы диагностики
Несмотря на многолетнюю историю изучения заболевания, строгие диагностические критерии при Malassezia-инфекциях животных до сих пор не установлены. Это связано с «оппортунистическим» характером и биологическими особенностями возбудителя.
Обнаружение клеток Malassezia spp. в очаге поражения животного само по себе не может свидетельствовать об этиологической роли гриба в конкретном случае, т.к. эти микроорганизмы обнаруживаются и у здоровых животных. Как отмечалось выше, при отитах и дерматитах у животных имеет место резкое увеличение популяции Malassezia spp. в очаге поражения по сравнению со здоровыми животными. С другой стороны, не всегда течение отита сопровождается увеличением популяции дрожжевых клеток. Для постановки адекватного диагноза и назначения адекватной терапии необходимо принимать во внимание комплекс диагностических факторов, включая клиническую картину, данные анамнеза, результаты дифференциальной диагностики.
Трудности диагностики Malassezia-инфекций связаны также и с биологическими особенностями возбудителя. Для выделения грибов рода Malassezia из патологического материала необходимы специальные липидсодержащие питательные среды, что обусловлено липидзависимостью возбудителя. В патологическом материале без надлежащих условий эти микроорганизмы очень быстро утрачивают жизнеспособность. Эти особенности определяют специфику диагностики Malassezia-инфекций на всех этапах исследования: отбор патологического материала, его транспортировка, цитологический и культуральный анализы, идентификация культуры, интерпретация его клинического значения.
Необходимо учитывать, что грибы рода Malassezia – лишь одна из возможных причин инфекционного отита или дерматита. В качестве возбудителей могут выступать различные виды других видов грибов, а также бактерии. Очень часто (по нашим данным, до 40% случаев) инфекции кожи вызываются ассоциацией микроорганизмов, куда входят и грибы, и бактерии. Исходя из этого, диагностические методы должны быть ориентированы не только на выявление малассезий, но на обнаружение всех потенциально-патогенных микроорганизмов, что значительно повысит диагностическую ценность исследования.
Алгоритм выявления грибов рода Malassezia значительно варьирует у разных исследователей. Используются различные методы отбора патологического материала, его транспортировки, способы количественной оценки популяции Malassezia spp., существенно варьируют методы культивирования и идентификации грибов. Наиболее распространенные способы взятия патологического материала обобщены в таблице 1.
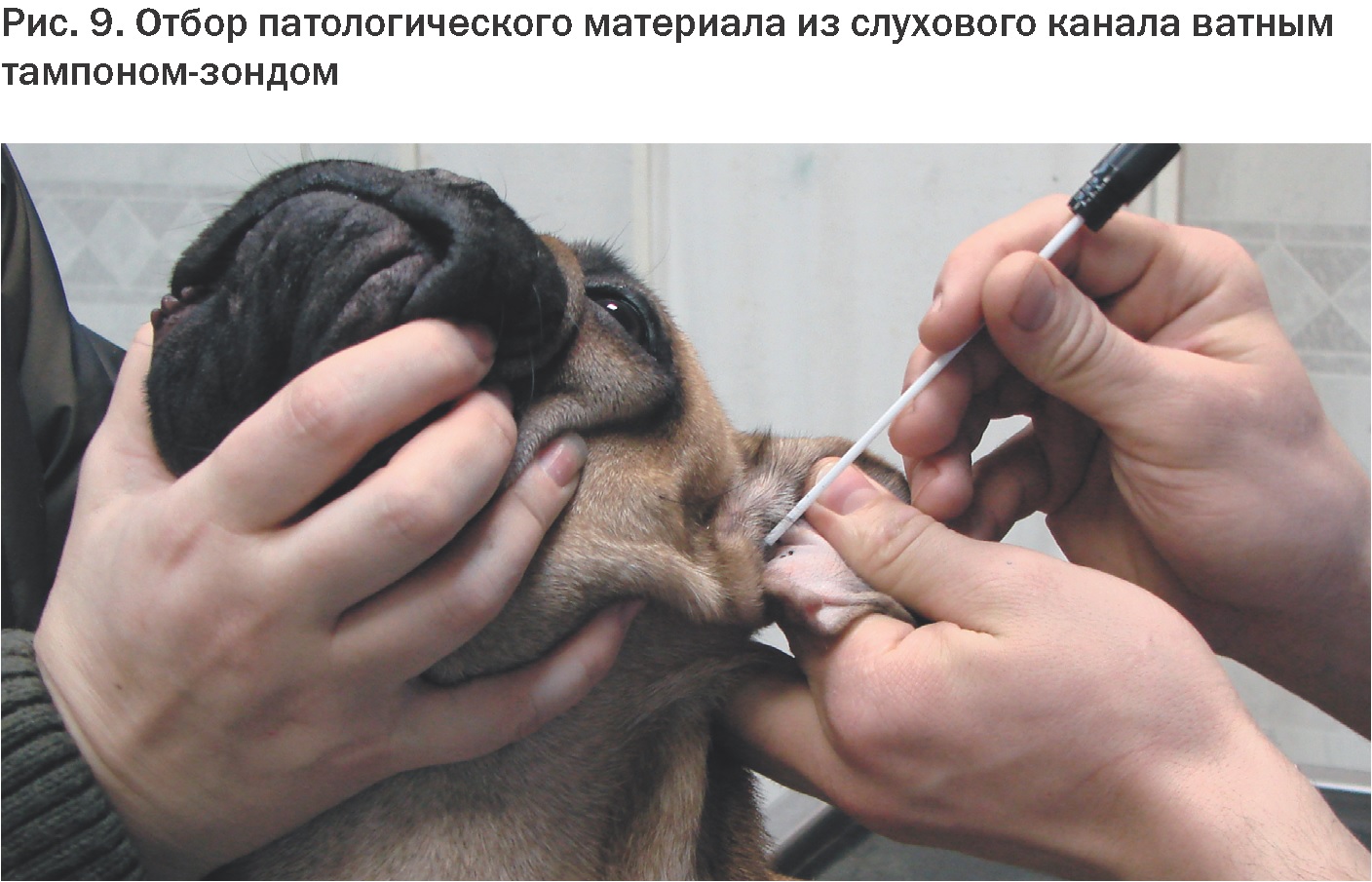
Сравнительная апробация данных методов отбора патологического материала показала, что оптимальным для повседневного использования в ветеринарной практике является метод с использованием ватного тампона-зонда (сухого или с транспортной средой). Использование тампона-зонда удобно, позволяет проводить отбор проб из труднодоступных участков тела, в т.ч. из слухового канала (Рис. 9). Метод пригоден и для цитологической, и для культуральной диагностики. При посевах на питательные среды возможна количественная оценка плотности популяции дрожжевых грибов. Некоторые авторы при отборе материала из слухового канала используют специальный стерильный конус, через который вводят тампон-зонд, что позволяет снизить контаминацию пробы микроорганизмами с ушной раковины [13].
Важнейшим условием является сохранность грибов рода Malassezia в собранных клинических образцах до начала культурального исследования. К сожалению, в доступной литературе этот вопрос практически не освещен. Как показывает наш собственный опыт, при хранении образцов в транспортной среде Эймса в течении 7 сут. жизнеспособность M. pachydermatis практически не снижается. При этом в образцах, хранившихся в сухих пробирках, количество жизнеспособных дрожжевых клеток значительно сокращается уже на 3 сут. хранения.
Для обнаружения грибов рода Malassezia в клиническом материале на практике используются цитологические, культуральные методы и их сочетание.
Цитологическое исследование
Обычно включает фиксацию препарата, его окраску и микроскопию в сухой или иммерсионной системе микроскопа. Для обнаружения клеток Malassezia может быть использовано несколько методов окраски. Большинство зарубежных авторов используют окраску Diff-Quick, являющуюся модифицированным методом Райта (Wright), и выпускаемую промышленным способом (Dade Behring, Deerfield, IL, USA; Baxter Diagnostics AG, Du-dingen, Switzerland и др.) При этом способе клетки гриба окрашиваются в сине-фиолетовый, реже в красно-розовый цвет. Однако этот метод окраски далеко не единственный и не может считаться безоговорочным стандартом.
L. Xiong et al. [14] применяли окраску метиленовым синим и окраску чернилами Паркер (Parker ink), при этом частота обнаружения Malassezia spp. существенно не отличалась и составила 96% при окраске метиленовым синим и 94% при окраске чернилами Паркера. Однако окраска метиленовым синим, в отличии от окраски чернилами, достаточно чувствительна и для обнаружения других дрожжевых грибов, в частности Candida spp. A. Padilha-Goncalves [15] успешно использовал окраску лактофеноловым синим. Colombo & Cornegliani [1] рекомендуют окраску кристалл-виолетом. По данным авторов, при этом методе дрожжевые клетки окрашиваются интенсивно и практически моментально. M. Crespo et al. [16] в своих исследованиях применяют окраску по Граму.
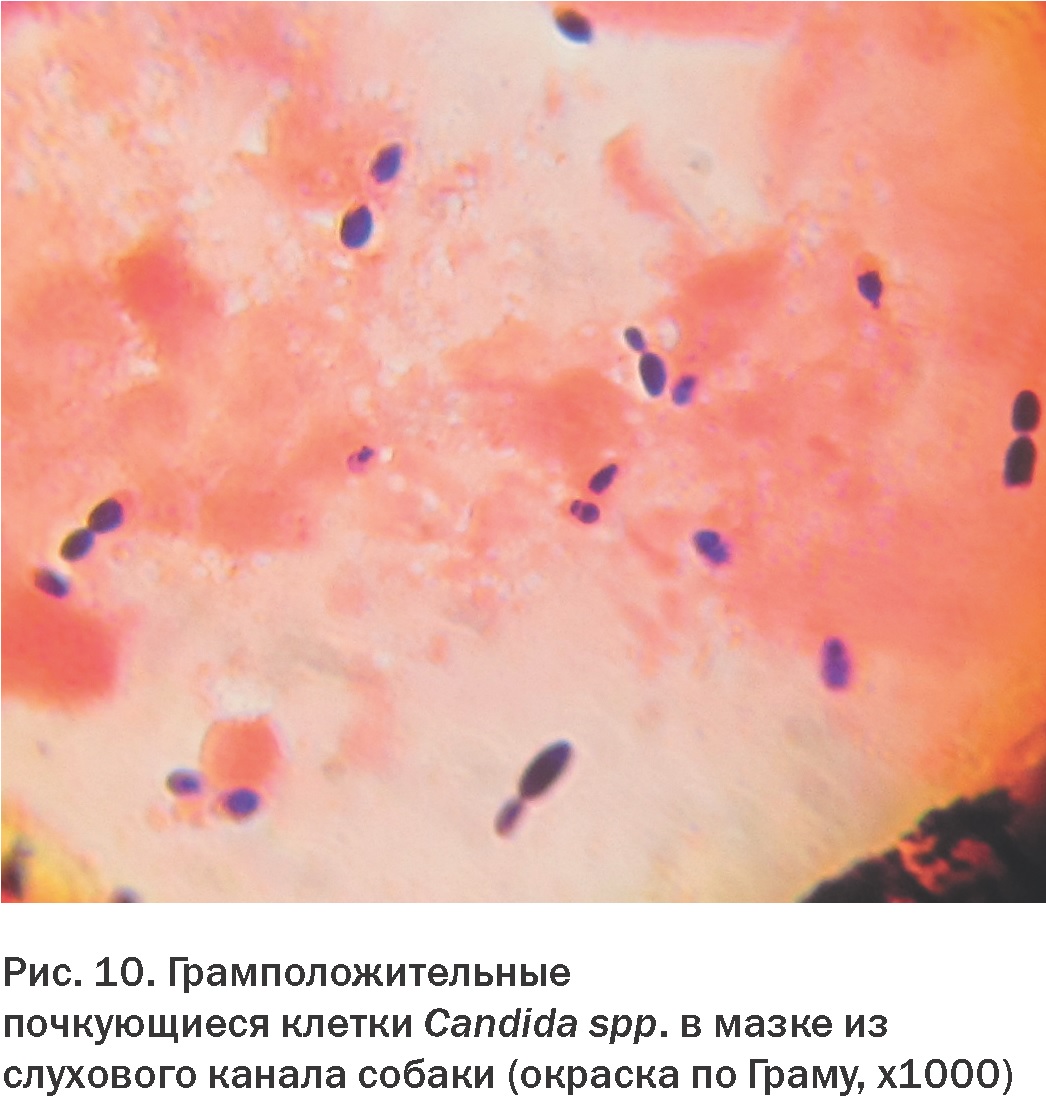
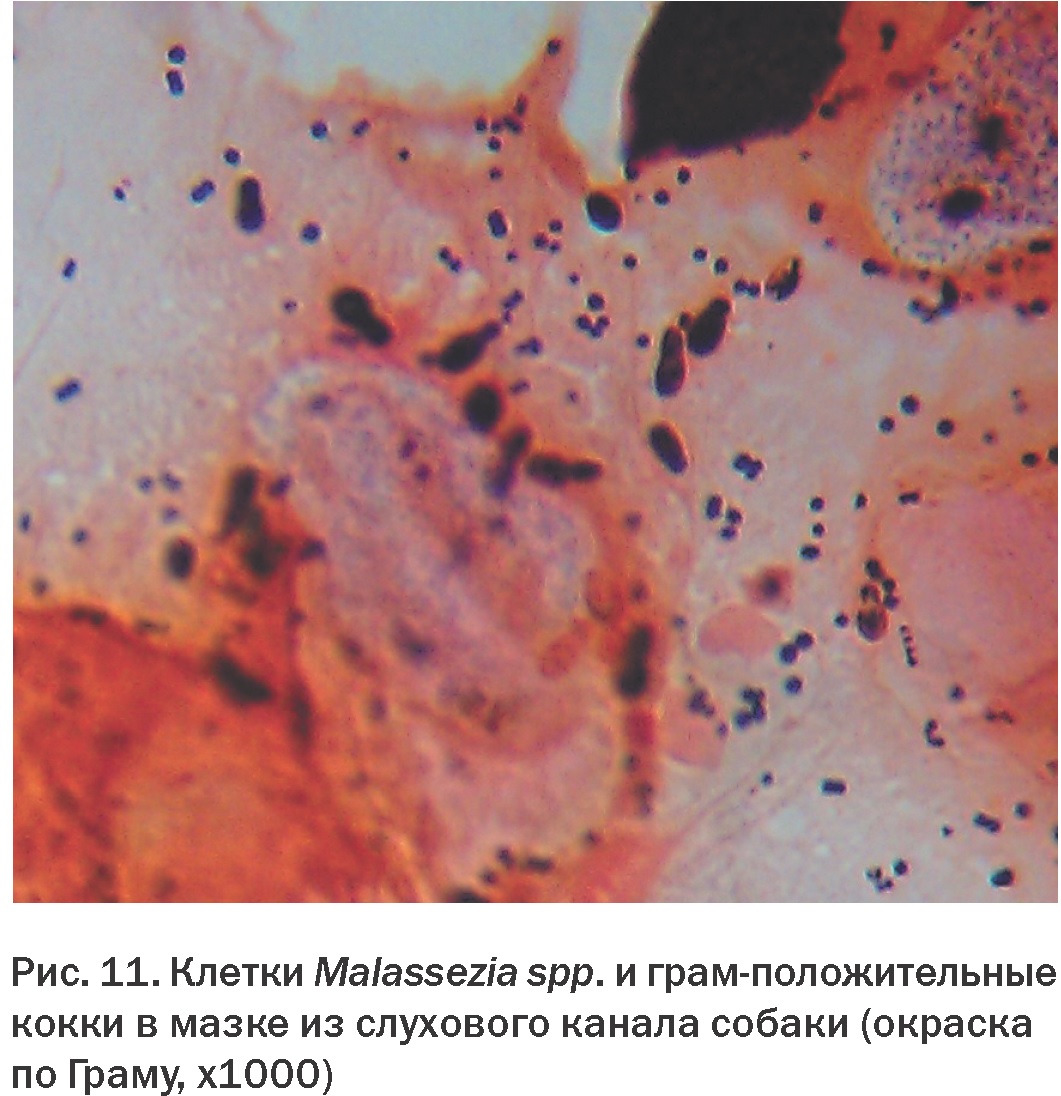
В наших собственных лабораторных исследованиях мы также применяем окраску мазков по Граму. При этом грибы рода Malassezia, а также Candida и другие, окрашиваются грамположительно, т.е. в темно-синий цвет (Рис. 10). Важнейшим преимуществом метода является то, что наряду с грибами он позволяет обнаружить и тинкториально дифференцировать бактериальные микроорганизмы, что значительно повышает информативность микроскопического исследования. Часто в препаратах наряду с грибами рода Malassezia обнаруживается бактериальная микрофлора (Рис. 11). В большинстве микробиологических лабораторий окраска по Граму используется и для микроскопии патматериала, и для микроморфологического изучения выделенных культур микроорганизмов и является бесспорным стандартом в бактериологии. Так как она вполне пригодна и для обнаружения дрожжевых грибов, внедрять в лаборатории дополнительные методы окраски не представляется целесообразным.
Микроскопию проводят при увеличении х1000 в иммерсионной системе, хотя ряд авторов использует сухую систему микроскопа (увеличение х400). Для оценки численности популяции грибов рода Malassezia до сих пор не существует стандартных общепринятых показателей. Так, D. Perrine считает, что диагностическое значение имеет обнаружение в препарате даже одной дрожжевой клетки. По мнению R. Rosychuk [17], в норме при микроскопии с иммерсией должны обнаруживаться лишь случайные, единичные клетки.
A. Foster, C. Foil [18] считают популяцию дрожжей повышенной, если наблюдается 5 и более клеток малассезий в поле зрения при х400. Такого же мнения придерживаются J. Angus [19], J. Beck et al. [20]. D. Morris et al. [21] считают максимально допустимым количеством 1 клетку в мазках с кожи и 5 клеток в мазках из ушного канала в одном поле зрения при микроскопии с иммерсией. Следует учитывать, что при цитологическом исследовании содержание дрожжевых клеток в разных полях зрения в одном и том же препарате может существенно колебаться, что снижает репрезентативность получаемых данных [22].
В нашей лабораторной практике мы достаточно редко сталкиваемся с проблемой интерпретации количества дрожжевых клеток. В большинстве случаев если в мазке от больных животных обнаруживаются клетки Malassezia spp., то они присутствуют в значительном количестве, однозначно свидетельствующем о высокой плотности популяции гриба. Тем не менее, когда обнаруживаются даже единичные клетки, это расценивается как настораживающий признак.
Результаты микроскопии всегда следует соотносить с данными культурального исследования (см. ниже).
Культуральное исследование
Для выделения грибов рода Malassezia из клинического материала предложен ряд питательных сред: среда Леминга-Нотмана (Leeming & Notman), колумбийский кровяной агар, среда MacConkey [24], дрожжевой мальт-агар (Yeast malt agar, YMA) [25], картофельно-глюкозный агар с хлорамфениколом [26], среда Сабуро с добавлением оливкового масла [21], модифицированная среда Диксона (m-Dixon) [27],
[28], [29], [30], [31], [32]. Среди авторов нет единого мнения, какая из них является оптимальной для рутинных диагностических исследований.
В наших исследованиях наиболее быстрое начало роста культур M. pachydermatis отмечали на липидсодержащих средах Барфатини и м-Диксон – визуально рост колоний на этих средах наблюдали уже на 2-е сутки, а у отдельных штаммов – спустя 24 ч. после посева. На средах без источников липидов (сусло-агар, среда Сабуро, ПД-2), визуально рост у всех штаммов отмечали на 3-е сут., а на среде с хлорамфениколом – только на 4-е сут. В дальнейшем для выделения грибов рода Malassezia из патологического материала мы использовали среду Барфатини, являющуюся липидсодержащией модификацией среды Сабуро. В отличие от среды м-Диксон, также проявившей высокие ростовые свойства для M. pachydermatis, среда Барфатини более доступна и проста в приготовлении.
Как уже отмечалось, грибы рода Malassezia не следует рассматривать обособленно, вне контекста других возбудителей, участвующих в патогенезе кожных поражений. Для получения наиболее информативных результатов микробиологического исследования, следует выявлять в материале не только грибы рода Malassezia, но и другие виды грибов, а также бактерии и актиномицеты. Для этих целей следует использовать соответствующий набор микологических и бактериальных питательных сред. В нашей практике при микробиологическом исследовании мы проводим одновременный посев на следующие питательные среды:
1. Среда Барфатини для выделения грибов рода Malassezia; также обеспечивает рост других дрожжевых и «плесневых» грибов;
2. Селективная среда для выделения грибов-дерматофитов;
3. Селективная среда для выделения стафилококков;
4. Селективная среда для выделения стрептококков/энтерококков;
5. Селективная среда для выделения бактерий семейства Enterobacteriaceae;
6. Обогащенная среда для выделения прихотливых микроорганизмов, не растущих на перечисленных выше средах (актиномицеты и др.)
Такая комбинация сред позволяет исчерпывающе охарактеризовать микробный пейзаж, обнаружить в очаге поражения практически весь комплекс потенциальных возбудителей. С экономической точки зрения такое комплексное исследование также целесообразнее, нежели проведение микологического и бактериологического исследований по отдельности.
Посев материала производят методом, позволяющим проводить количественный учет выросших колоний (метод «тампон-петля» или аналогичный).
Культивирование проводят при 360С в течение 24-48 ч, однако в некоторых случаях рост малассезий может наблюдаться только на 3-4 сут. После этого срока посевы на среде Барфатини культивируют при комнатной температуре до 10-14 дней для обнаружения роста «плесневых» грибов. Посевы на селективной среде для дерматофитов инкубируют при 280С до 21 сут.
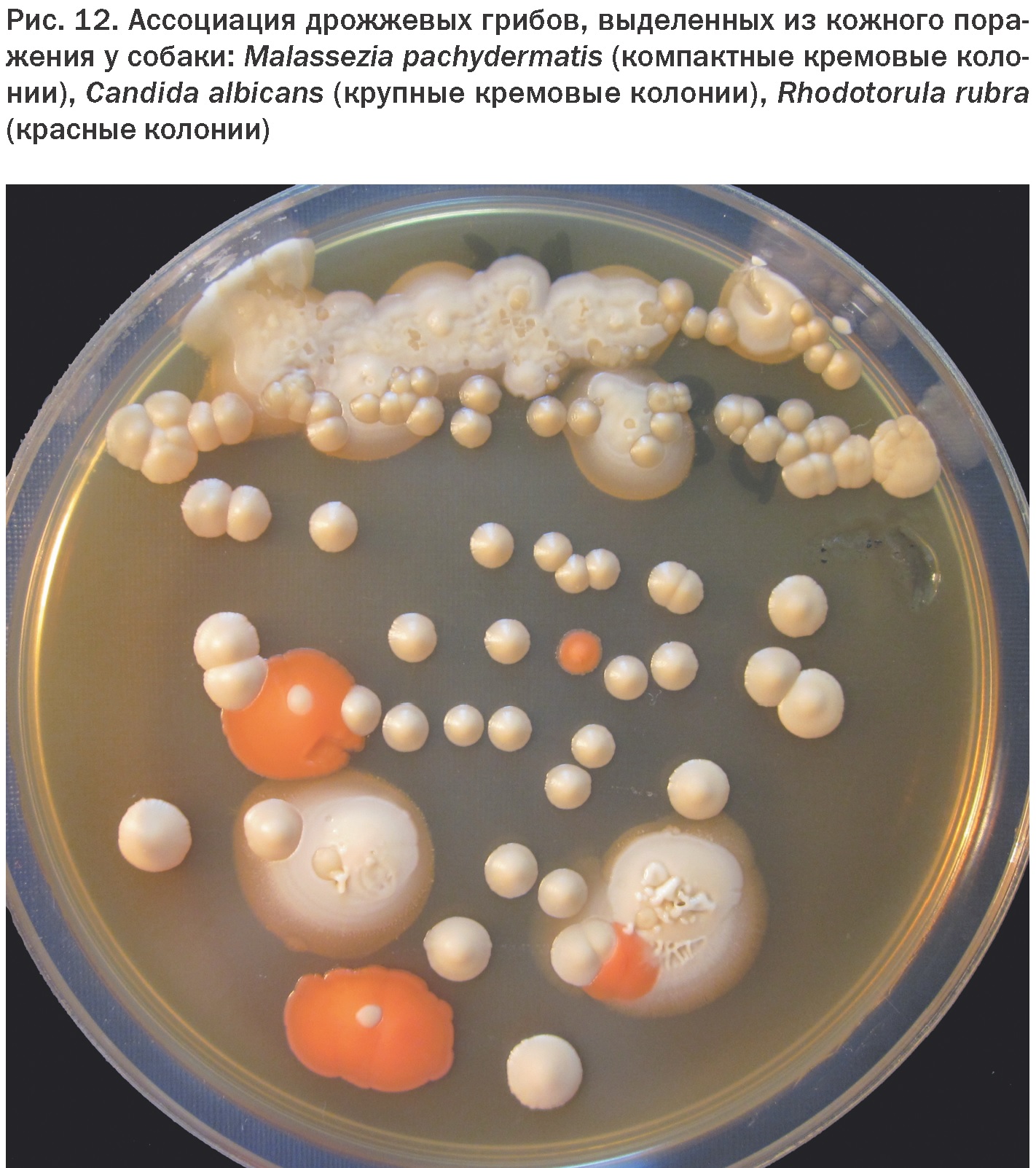
В результате микологического посева может быть выделена не одна культура гриба, а две и более, каждая из которых может играть роль в патогенезе. На рис. 12 представлена ассоциация дрожжевых грибов – M. pachydermatis, Candida albicans, Rhodotorularubra, выделенных из кожных поражений на лапах у боксера. Очевидно, что при такой комплексной этиологии необходим специфический терапевтический подход.
Видовая идентификация
Ключевым этапом в идентификации грибов рода Malassezia является определение липидной зависимости изолята, т.к. единственный зоофильный вид M. pachydermatis в отличие от остальных видов этого рода, способен расти на питательной среде, не содержащей липидов. Для определения липидной зависимости первичные изоляты дрожжей с липидсодержащей среды пересевают на среду Сабуро. Это позволяет диагностировать вид M. pachydermatis, наиболее распространенный возбудитель малассезиозов животных. Если изолят не способен к росту на этой среде, тогда возникает необходимость в дополнительных идентификационных тестах, которые могут быть проведены в специализированной микологической лаборатории.
У выделенных культур Malassezia spp. и других грибов проводят определение чувствительности к набору антифунгальных препаратов, обычно используя для этого дискодиффузионный метод. Данный тест имеет большое практическое значение, т.к. чувствительность грибов к различным антифунгальным препаратам может существенно варьировать [33], [34]. Рис. 13 иллюстрирует различия в уровне чувствительности к антимикотикам у клинических изолятов дрожжей.
Очевидно, что по сравнению с цитологическим исследованием, культуральное является более длительным и трудоемким. Насколько же оно оправдано? На этот вопрос отвечает ряд публикаций, в которых сравнительно изучалась чувствительность цитологического и культурального метода диагностики Malassezia-инфекций. В исследовании M. Crespo et al. [27] частота обнаружения Malassezia spp. культуральным методом составила 21,2%, цитологическим – 15,1%. По данным A. Kumar et al. [35], частота обнаружения Malassezia spp. у собак составила 39,4% при цитологическом анализе и 45,4% - при культуральном. A. Omodo-Eluk et al. (36) обнаружили дрожжи рода Malassezia на коже у 53% собак при культуральном исследовании и у 32% - при цитологическом. C. Cafarchia et al. [37] сообщают о бесспорном преимуществе культурального метода диагностики и предлагают использовать его в качестве «золотого стандарта». По представленным данным, цитологический метод проявил высокую специфичность (95%), однако крайне низкую чувствительность (лишь 30%). J. Angus [19] считает наиболее достоверным комбинированное применение цитологического и культурального исследования.
Таким образом, исследования убедительно продемонстрировали более высокую чувствительность культурального метода по сравнению с цитологическим. Он также обладает следующими преимуществами:
- объективная количественная оценка плотности популяции Malassezia spp. в очаге поражения;
- точная видовая идентификация возбудителя, причем не только грибов рода Malassezia, но и других видов грибов, а также бактерий и ассоциаций различных видов микроорганизмов;
- возможность определения чувствительности гриба-возбудителя к антимикотикам, а бактерий – к антибиотикам;
Вместе с тем, мы разделяем точку зрения J. Angus, считающего, что максимально достоверных результатов позволяет добиться совместное применение микроскопического и культурального методов. В ряде случаев гриб в клиническом образце утрачивает жизнеспособность, и не может быть выделен в культуру, но может быть обнаружен микроскопически. То же касается высоко требовательных микроорганизмов, которые не могут быть выделены на общеупотребительных питательных средах. Алгоритм диагностики Malassezia-инфекций детально изложен в «Методических указаниях по диагностике микозов животных, вызываемых грибами рода Malassezia» (ФГУ «ВГНКИ») [38].
Терапия
При терапии должна учитываться прежде всего оппортунистическая природа Malassezia-инфекций, т.е., для полноценного выздоровления необходимо не только этиотропное лечение, но и выявление у каждого животного ведущего патогенетического фактора, ответственного за создание условий для развития микоза.
Устранение или снижение влияния предрасполагающих факторов является обязательным условием как для лечения, так и профилактики рецидивов Malassezia-инфекций.
При этиотропном лечении следует принимать во внимание следующие аспекты:
- специфическое противогрибковое лечение должно назначаться на основании результатов лабораторного микологического исследования;
- т.к. обычно инфекции кожи вызываются ассоциацией грибов и бактерий, следует также диагностировать и элиминировать бактериальных возбудителей;
- следует принять меры к снижению содержания липидов на кожном покрове, скорректировать рН кожи, снизить воспалительную реакцию, что создаст неблагоприятные условия для жизнедеятельности Malassezia spp.
Особенности терапии Malassezia-отитов. Терапия наружных Malassezia-отитов базируется на препаратах местного действия. Т.к., данное заболевание носит исключительно поверхностный характер, системные препараты, как правило, не достигают терапевтических концентраций в ушном секрете, в силу чего не могут эффективно воздействовать на возбудитель. Системная терапия может быть показана только в случае глубокой эрозии или изъязвления слухового канала, при трансформации наружного отита в средний [39].
Большинство коммерческих препаратов, предназначенных для лечения инфекционных отитов, содержат комбинацию активных веществ – противобактериального, противогрибкового и противовоспалительного действия. Основа (матрица) лекарственного препарата имеет большое значение – ее состав влияет как на активность действующих веществ, так и на их биодоступность. Некоторые основы могут обладать раздражающим действием, т.е., препараты местного действия должны быть хорошо сбалансированы по своему составу. В них могут быть использованы следующие противогрибковые агенты.
Нистатин. Антимикотик полиенового ряда, связывающийся со стеролами клеточной мембраны грибов, нарушая проницаемость клетки и вызывая ее осмотическое разрушение. В основном нистатин применяется для лечения кандидозов, однако в некоторых исследованиях также показана его клиническая эффективность при Malassezia-инфекциях [17]. Обычно нистатин выпускается в форме обтурирующих мазей, что ограничивает его использование при экссудативных или церуминозных наружных отитах.
Антимикотики азолового ряда. Имидазолы (клотримазол, миконазол, кетоконазол) и триазолы (итраконазол, флуконазол) имеют одинаковый механизм противогрибкового действия: нарушение синтеза эргостерола клеточной стенки грибов путем ингибирования системы цитохрома Р450. По данным R. Lorenzini et al. [40], по эффективности в отношении Malassezia spp. азолы распределяются следующим образом: клотримазол (по эффективности сравним с нистатином), миконазол (в 10 раз эффективнее нистатина), кетокназол и итраконазол. Штаммы различного географического происхождения могут варьировать по чувствительности к тем или иным азолам.
Клотримазол и миконазол в составе ряда ветеринарных препаратов широко используются для терапии Malassezia-отитов собак и кошек. В клинических условиях устойчивость малассезий к клотримазолу наблюдают чаще, чем к миконазолу. Кетоконазол доступен только в форме медицинских препаратов (таблетки, кремы). В ряде случаев ветеринары самостоятельно изготавливают из них 1-2% формы для лечения отитов, когда другие азолы оказываются неэффективны. Итраконазол преимущественно используется как системный препарат, однако выпускается также в форме 1% раствора (эликсира) для полоскания ротовой полости. Имеются сообщения об эффективности данной формы при наружном применении в ветеринарии [39].
В 2009 г. на международный рынок был выпущен ветеринарный препарат против отитов, в состав которого входит позаконазол – новый антимикотик азолового ряда. По данным P. Bourdeau et al. [41], позаконазол проявляет высокую активность в отношении M. pachydermatis в опытах in vitro. Данные о его клинической эффективности пока очень ограничены.
Хотя в целом азолы не проявляют ототоксичность, в отдельных случаях могут наблюдаться контактные реакции (раздражение кожи). Однако эти реакции могут быть вызваны не самим антимикотиком, а другими компонентами лекарственной формы, в т.ч., ее основой.
Аллиламины. Антимикотики этого ряда вызывают нарушение биосинтеза эргостерола путем ингибирвоания эпоксидазы сквалена. В опытах in vitro показана высокая активность тербинафина в отношении многих видов рода Malassezia, в т.ч. M. pachydermatis [42]. Однако по данным B. Sancak et al. [43], по уровню активности тербинафин уступает итраконазолу и кетоконазолу; при этом в отношении половины изолятов Malassezia spp. он проявил низкую активность. Данный антимикотик не имеет ветеринарной аккредитации ни в России, ни за рубежом, хотя медицинские формы для местного применения доступны во многих странах. Основным назначением тербинафина является лечение дерматофитозов, для терапии малассезиозов он применяется крайне редко.
При терапии Malassezia-отитов важную роль играют кортикостероиды – они обладают сосудораcширяющим, противовоспалительным, антипролиферативным действием, снижают экссудацию, уменьшают зуд. При системном применении стероиды способны уменьшить как острый, так и хронический стеноз ушного канала. Единственным нестероидным средством, которое может быть использовано при наружных отитах – раствор диметил сульфоксида (ДМСО) [39].
Препараты, предназначенные для лечения Malassezia-отитов, должны применяться в соответствии с инструкцией, однако P. Bourdeau [6] предлагает придерживаться нескольких общих правил:
- перед применением лекарственных препаратов необходима тщательная чистка слухового канала от ушных выделений, которые могут снижать эффективность действия;
- при церуминозных формах отитов рекомендуется применение препаратов на масляной основе, при экссудативных формах – на водной;
- все препараты должны вводиться в слуховой канал теплыми;
- для введения препарата не следует пользоваться ушными палочками;
- после введения препарата проводят массаж основания уха в течение 1-2 мин.
- применение этиотропных средств обычно сочетают с очисткой ушного канала с помощью лосьонов.
Стойкое выздоровление после первичной терапии наблюдается довольно редко (25% случаев). В 29% наблюдают клиническое улучшение, в 22% - персистенцию инфекции, в 23% - рецидивы [6]. Существенную проблему может представлять лечение хронических и рецидивирующих Malassezia-отитов. Могут потребоваться длительные курсы местной этиотропной терапии (обычно не менее 4 недель). Следует иметь ввиду, что в процессе лечения может развиться устойчивость возбудителя к используемому антимикотику. При глубоких изменениях ушных тканей может потребоваться системное применение антимикотиков и/или антибиотиков, в зависимости от результатов комплексного микробиологического исследования. С интервалом 2-4 недели проводят отоскопическое и микробиологическое обследование животного, до достижения полного клинического и микологического выздоровления. Выявляют и по возможности устраняют предрасполагающие факторы.
Особенности терапии Malassezia-дерматитов. Как и при Malassezia-отитах, основу терапии составляют противогрибковые препараты местного действия. Они используются как при локализованных, так и при генерализованных формах. Системная терапия обычно назначается в случаях, когда местное лечение по каким-либо причинам невозможно. При длительной терапии сложных рецидивирующих случаев особенно предпочтительна местная терапия для минимизации токсических эффектов, присущих системным антимикотикам.
Помимо специфического противогрибкового лечения, необходима коррекция сопутствующих факторов. Применяют противовоспалительные средства для снижения экссудации и зуда; принимают меры к обезжириванию кожи, при этом, однако, не допуская ее пересушивания. Параллельно с противогрибковой проводят антибактериальнаую терапию, т.к. в большинстве случаев в патогенезе заболевания бактерии участвуют наряду с липофильными дрожжами. В случае моноинфекции комбинированная терапия предотвращает переход дрожжевой инфекции в бактериальную, и наоборот [44]. Как неоднократно подчеркивалось, залогом успешной терапии является выявление и устранение первичных предрасполагающих факторов.
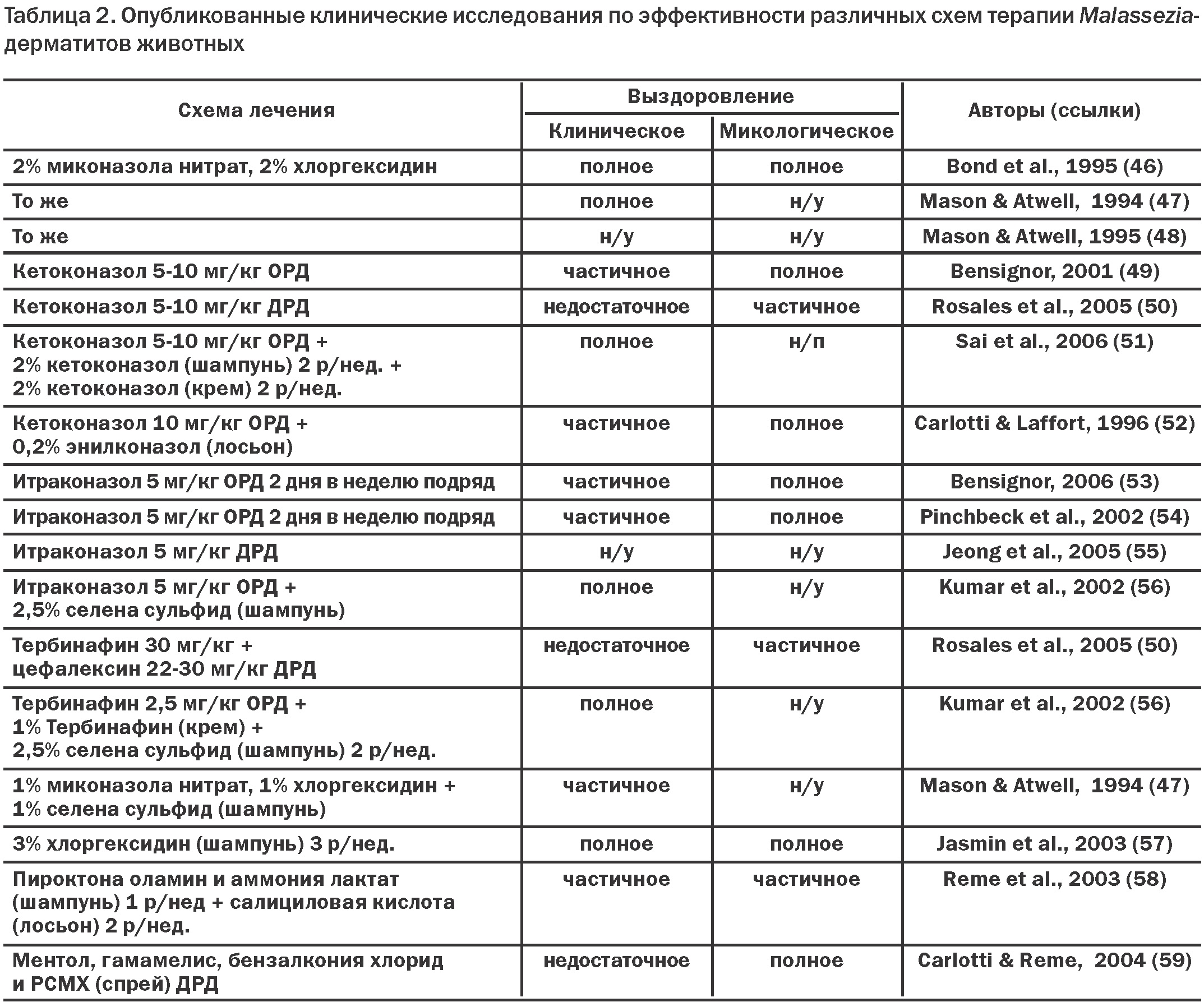
Несмотря на распространенность Malassezia-дерматитов, в литературе опубликовано относительно немного клинических исследований эффективности терапевтических средств, которые соответствовали бы критериям доказательной медицины. A. Negre et al. [45] в своем исчерпывающем обзоре обобщили имеющиеся публикации по данному вопросу и сделали попытку определить оптимальный способ терапии Malassezia-дерматитов животных (Табл. 2).
В исследованиях применялись как местные, так и системные препараты, а также их сочетание. В некоторых протоколах лечения специфические антимикотики не использовались. Оценка эффективности осложнялась тем, что часто препараты применялись в комбинациях, а эффективность компонентов по отдельности не изучалась. Так, эффективность хлоргексидина изучалась в 4 исследованиях, и в 3 из них он применялся в комбинации с еще одним компонентом. Только в одном исследовании был использован 3% шампунь хлоргексидина без добавок, 3 раза в неделю в течение 3 недель, и проявил клиническую и микологическую эффективность.
Дозировка, частота введения и длительность курсов антимикотиков значительно варьировали у разных авторов. Так, кетоконазол применялся в дозах 5 мг/кг 1 раз в день, 10 мг/кг 1 раз в день, 10 мг/кг 2 раза в день. Тербинафин применяли в дозах 2,5 мг/кг один раз в день, и 30 мг/кг 1 раз в день. Длительность курсов местной терапии составляла обычно 2-3 недели.
Проанализировав доступные публикации и репрезентативность представленных данных, A. Negre et al. сделали вывод, что для эффективного лечения Malassezia-дерматитов достаточно использования шампуня с 2% миконазола и 2% хлоргексидина, дважды в неделю в течение 3 недель. Такой же протокол лечения рекомендуется в Директиве ESCCAP (Европейский Научный Совет по паразитозам животных-компаньонов) [44].
При необходимости системного лечения может быть использован кетоконазол (в дозе 5-10 мг/кг), или итраконазол (5 мг/кг в 1 раз в день в течение 3 недель). Кетоконазол проявляет одинаковую эффективность в дозах 5 мг/кг и 10 мг/кг. Целесообразно использовать меньшую дозировку, что снизит стоимость лечения, а также вероятность побочных эффектов, включая анорексию, рвоту, диарею. Итраконазол может использоваться для пульс-терапии, т.к. он накапливается в кератинизированных тканях. Это упрощает лечение и делает его менее дорогостоящим. Кроме того, итраконазол переносится легче, нежели кетоконазол. Достоверных различий по эффективности между ежедневным лечением кетоконазолом и пульс-терапией итраконазолом не отмечено.
Следует помнить, что оба эти антимикотика не имеют маркетинговой авторизации для лечения малассезиозов собак ни за рубежом, ни в России. В некоторых странах итраконазол лицензирован для лечения кошек, поэтому часть ветеринаров относится к нему с большим доверием, нежели к кетоконазолу, и при лечении собак. Что касается системного применения тербинафина, то его эффективность при Malassezia-дерматитах собак недостаточно обоснована в имеющихся публикациях. Также, по мнению A. Negre et al., нет достаточных оснований рекомендовать для местного лечения монопрепараты миконазола, энилконазола, хлоргексидина. Во многих случаях при Malassezia-дерматитах требуется периодическая поддерживающая противогрибковая терапия для предотвращения рецидивов [44].
В последнее время в научной литературе самое пристальное внимание уделяется изучению лекарственных средств растительного происхождения, возможности их использования для терапии инфекционных (грибковых и бактериальных) заболеваний. Лекарственные средства растительного происхождения представляются перспективной альтернативой химиотерапевтическим антимикотикам в силу их дороговизны и наличию побочных эффектов. Имеющиеся на сегодня научные данные демонстрируют перспективность использования некоторых растительных препаратов для лечения грибковых заболеваний, в т.ч., вызываемых грибами рода Malassezia. Так, K. A. Hammer et al. [60] изучали активность масла чайного дерева (Melaleuca alternifolia) в отношении 5 видов рода Malassezia, параллельно с кетоконазолом, миконазолом и эконазолом. Установлено, что масло Melaleuca alternifolia ингибировало M. furfur, M. sympodialis, M. slooffiae, M. globosa и M. obtusa, причем по уровню активности оно значительно превосходило миконазол и эконазол и было сравнимо с кетоконазолом. P. Nenoff et al. [61] также сообщают о высокой активности масла чайного дерева в отношении 22 штаммов M. furfur, а также других патогенных грибов – дерматофитов и грибов рода Candida. C. Carson et al. (2006) подчеркивают, что растению Melaleuca alternifolia присущи не только противогрибковые, но и противобактериальные и противовоспалительные свойства, что делает его высоко перспективным средством для лечения инфекций кожи [62]. Высокая противогрибковая активность обнаружена также у целого ряда растений: Santalum album, Cymbopogon citratus, Mentha spicata, Origanum vulgare, Pimenta racemosa, Syzigum aromaticum, Citrus auran-tium и других [63].
Заключение
Инфекции, вызываемые грибами рода Malassezia – острая актуальная проблема ветеринарной микологии. Они широко распространены среди собак, кошек и других видов животных; могут поражать слуховой канал, кожу, а также слизистые оболочки внутренних органов. Клинически часто мимикрируют другие заболевания, в силу чего для достоверной диагностики необходимо лабораторное микробиологическое исследование, с параллельным выявлением бактериальной микрофлоры. Для успешной терапии Malassezia-инфекций важно диагностирование и устранение первичных предрасполагающих факторов. Для противогрибковой терапии используют местные антимикотики азолового ряда; большой интерес представляют противогрибковые вещества растительного происхождения.
Литература
1. Colombo S, Cornegliani L. Prevalence of Malassezia spp. in feline nail folds: a cytological study. Vet Dermatol 2000;11(suppl. 1):38.
2. Prado M, Brito E, Girao M, Monteiro A, Sidrim J, Rocha M. Higher incidence of Malassezia pachydermatis in the eyes of dogs with corneal ulcer than in healthy dogs. Vet Microbiol 2004;100:115-20.
3. Pinter L, Noble WC. Stomatitis, pharyngitis and tonsillitis caused by Malassezia pachydermatis in a dog. Veterinary. 1998;9(4):257-61.
4. Ивченко, О.В. Диагностика малассезиозов животных. Автореферат диссертации на соискание ученой степени кандидата ветеринарных наук. Москва: ГНУ ВИЭВ; 2010.
5. Ginel P Lucena R, Rodriguez J, Ortega J. A semiquantitative cytological evaluation of normal and pathological samples from the external ear canal of dogs and cats. Vet Dermatol 2002;13(3):151-6.
6. Bourdeau P Наружный отит у собак и кошек. Концепция лечения. Доклад на Предконгрессном дне XXI Московского Международного Ветеринарного Конгресса по болезням мелких домашних животных. 19 апреля 2013 г., ГК «Измайлово».
7. Ершов ПП. Этиологическая значимость дрожжевых грибов рода Malassezia при кожных заболеваниях животных. Дисс.канд. вет. наук. Москва, 2008. 162 стр .
8. Федоров, Л.Н. Новые аспекты диагностики и лечения при питироспорозе у собак. Автореферат диссертации на соискание ученой степени кандидата ветеринарных наук. п. Персиановский: Северо-Кавказский зональный научно-исследовательский ветеринарный институт; 2009.
9. Mauldin E, Morris D, Goldschmidt M. Retrospective study: the presence of Malassezia in feline skin biopsies. A clinicopathological study. Vet Dermatol. 2002;13(1):7-13.
10. McEwan N. Malassezia and Candida infections in bull terriers with lethal acrodermatitis. J Small Anim Pract. 2001;42(6):291-7.
11. Вильгельм С. Отит у собак – все еще проблема для практикующего ветеринара? Материалы II Международного ветеринарного дерматологического симпозиума. Санкт-Петербург, 30-31 марта 2013 г. 2013:48-53.
12. Паттерсон С. Кожные болезни собак. Москва: Аквариум; 2011. 176 p.
13. Fernndez G BG, Villalobos A. Isolation and Identification of microorganisms present in 53 dogs suffering otitis externa. Revista Cient fica. 2006;16(1):23-30.
14. Xiong L, Dai YL. [Application of methylene blue staining in detection of Malassezia]. Sichuan da xu = Journal of Sichuan University Medical science edition. 2004;35(2):277-9. Epub 2004/04/10.
15. Padilha-Goncalves A. A single method to stain Malassezia furfur and Corynebacterium minutissimum in scales. Revista do Insti-tuto de Medicina Tropical de Sao Paulo. 1996;38(4):299-302. Epub 1996/07/01.
16. Crespo MJ, Abarca ML, Cabanes FJ. Atypical lipid-dependent Malassezia species isolated from dogs with otitis externa. J Clin Micro-biol. 2000;38(6):2383-5. Epub 2000/06/02.
17. Rosychuk RA. Management of otitis externa. Vet Clin North Am Small Anim Pract. 1994;24(5):921-52.
18. Foster A, Foil C. BSAVA manual of small animal dermatology. England: British small animal veterinary association; 2003.
19. Angus JC. Otic cytology in health and disease. Vet Clin North Am Small Anim Pract. 2004;34(2):411-24.
20. Beck J, W. Canine otitis externa: evaluation of clinical classification using cytology and bacteriology. Veterinary dermatology. 2000;11(suppl. 1):52.
21. Morris DO. Malassezia pachydermatis carriage in dog owners. Emerg Infect Dis. 2005;11(1):83-8.
22. Reme CA. Factors associated with Malassezia colonization in the ear canals of healthy dogs. Veterinary dermatology. 2004;15(suppl. 1):15.
23. Leeming JP, Notman FH. Improved methods for isolation and enumeration of Malassezia furfur from human skin. J Clin Microbiol. 1987;25(10):2017-9. Epub 1987/10/01.
24. Blanco JL, Guedeja-Marr n J. Optimum incubation conditions for the isolation of yeasts from canine otitis externa. J Vet Med B Infect Dis Vet Public Health. 2000;47(8):599-605.
25. Bernardo FM, Martins HM, Martins ML. A survey of mycotic otitis externa of dogs in Lisbon. Rev Iberoam Micol. 1998;15:163-5.
26. Hernndez-Escare o J, Sandoval – Coronado C, Salinas – Melndez J, Riojas - Valdez V. Malassezia pachydermatis in dogs with external otitis from Monterrey , Nuevo Le n , M xico. African Journal of Microbiology Research. 2013;6(10):2443-8.
27. Crespo MJ, Abarca ML, Cabanes FJ. Isolation of Malassezia furfur from a Cat. J Clin Microbiol. 1999;37(5):1573-4.
28. Mancianti F, Rum A, Nardoni S, Corazza M. Extracellular enzymatic activity of Malassezia spp. isolates. Mycopathologia. 2001;149(3):131-5.
29. Bensignor E, Jankowski F, Seewald W, Touati F, Deville M, Guil-lot J. Comparison of two sampling techniques to assess quantity and distribution of Malassezia yeasts on the skin of Basset Hounds. Vet Dermatol. 2002;13(5):237-41.
30. Raabe P Mayser P Weiss R. Demonstration of Malassezia furfur and M. sympodialis together with M. pachydermatis in veterinary specimens. Mycoses. 1998;41(11-12):493-500.
31. Prado MR, Brito EH, Girao MD, Monteiro AJ, Sidrim JJ, Rocha MF. Higher incidence of Malassezia pachydermatis in the eyes of dogs with corneal ulcer than in healthy dogs. Vet Microbiol. 2004;100(1-2):115-20. Epub 2004/05/12.
32. Bond R, Lloyd DH. Comparison of media and conditions of incubation for the quantitative culture of Malassezia pachydermatis from canine skin. Res Vet Sci. 1996;61(3):273-4.
33. Gupta AK, Nicol K, Batra R. Role of antifungal agents in the treatment of seborrheic dermatitis. American journal of clinical dermatology. 2004;5(6):417-22. Epub 2005/01/25.
34. Guisiano G. Malassezia. Current knowledge and study perspectives. Revista Argentina de Microbiolog a. 2006;38:41-8.
35. Kumar A, Singh K, Sharma A. Prevalence of Malassezia pachydermatis and other organisms in healthy and infected dogs ears. Israel Vet Med Assoc. 2002;57:145-8.
36. Omodo-Eluk AJ, Baker KP Fuller H. Comparison of two sampling techniques for the detection of Malassezia pachydermatis on the skin of dogs with chronic dermatitis. Vet J. 2003;165(2):119-24.
37. Cafarchia C, Gallo S, Capelli G, Otranto D. Occurrence and population size of Malassezia spp. in the external ear canal of dogs and cats both healthy and with otitis. 2005;160(2):143-9.
38. Маноян МГ, Овчинников РС, Ершов ПП. Методические указания по диагностике микозов животных, вызываемых грибами рода Malassezia. Москва, ФГУ «ВГНКИ», 2007, 10 стр.
39. Morris DO. Medical therapy of otitis externa and otitis media. Vet Clin North Am Small Anim Pract. 2004;34(2):541-55, vii-viii. Epub 2004/04/06.
40. Lorenzini R, Mercantini R, De Bernardis F. In vitro sensitivity of Malassezia spp. to various antimycotics. Drugs Exp Clin Res. 1985;11(6):393-5.
41. Bourdeau P, Marchand A, F E. In vitro activity of posaconazole and other antifungals against Malassezia pachydermatis isolated from dogs. Veterinary Dermatology. 2004; 15 (S 1):46-(1).
42. Gupta AK, Kohli Y, Li A, Faergemann J, Summerbell RC. In vitro susceptibility of the seven Malassezia species to ketoconazole, voriconazole, itraconazole and terbinafine. The British journal of dermatology. 2000;142(4):758-65. Epub 2000/05/03.
43. Sancak B, Ayhan M, Karaduman A, Arikan S. [In vitro activity of ketoconazole, itraconazole and terbinafine against Malassezia strains isolated from neonates]. Mikrobiyoloji bulteni. 2005;39(3):301-8. Epub 2005/12/20. Yenidoganlardan izole edilen Malassezia suslarinin ketokonazol, itrakonazol ve terbinafine in vitro duyarliligi.
44. Anonymous. Superficial mycoses in dogs and cats. ESCCAP Guideline. Malvern, UK: European Scientific Councel Companion Animals Parasites; 2011. 15 p.
45. Negre A, Bensignor E, Guillot J. Evidence-based veterinary dermatology: a systematic review of interventions for Malassezia dermatitis in dogs. Vet Dermatol. 2008;20(1):1-12.
46. Bond R, Rose JF, Ellis JW, Lloyd DH. Comparison of two shampoos for treatment of Malassezia pachydermatis-associated seborrhoeic dermatitis in basset hounds. J Small Anim Pract. 1995;36(3):99-104.
47. Mason K, Atwell R. Clinical efficacy studies on sebolyseshampoo. Proceedings of the 10th Annual Congress of the American Academy and American College of Veterinary Dermatology, Charleston, 1994: 56-7. 1994. p. 56-7.
48. Mason K, Atwell R, editors. Clinical efficacy trials on a chlorhe-xidine/miconazole shampoo for the treatment of seborrhoeic dermatitisassociated with an overgrowth of Malassezia pachydermatitisand coccoid bacteria. Proceedings of the 12th Annual Congressof the European College and the European Society of Veterinary Dermatology, Barcelona. 1995.
49. Bensignor E. Comparaison de deux posologies de ketoconazole pour le traitement de la dermatite a Malassezia chez le chien. Annales de M decine Vt rinaire. 2001;145(5):311-6.
50. Rosales MS, Marsella R, Kunkle G, Harris BL, Nicklin CF, Lopez J. Comparison of the clinical efficacy of oral terbinafine and ketoconazole combined with cephalexin in the treatment of Malassezia dermatitis in dogs – a pilot study. Vet Dermatol. 2005;16(3):171-6.
51. Sai J, Madhavi S, Satish K. Therapeutic studies on seborrheic dermatitis in dogs associated with Malassezia pachydermatis. Indian Veterinary Journal. 2006; 83(2):162-4.
52. Carlotti D-N, Laffort-Dassot C. Dermatite a Malassezia chez le chien: Etude bibliographique et retrospective de 12 cas generalises traites par des derives azoles. Pratique Medicale et Chirurgicale de l'Animal de Compagnie. 1996; 31(4):297-307.
53. Bensignor E. Oral itraconazole as a pulse therapy for the treatment of canine Malassezia dermatitis: a randomized, blinded, comparative trial. PRATIQUE MEDICALE ET CHIRURGICALE DE L ANIMAL DE COMPAGNIE. 2006;41(2):69-72.
54. Pinchbeck LR, Hillier A, Kowalski JJ, Kwochka KW. Comparison of pulse administration versus once daily administration of itraconazole for the treatment of Malassezia pachydermatis dermatitis and otitis in dogs. J Am Vet Med Assoc. 2002;220(12):1807-12.
55. Jeong A-yH, W.-p. Jeong, H.-h. Eom, K.-d. Lee, K.-w. Oh, T.-h. Efficacy of Itraconazole in 18 Cases of Malassezia Dermatitis in Dogs. JOURNAL OF VETERINARY CLINICS. 2005;22(2):90-3.
56. Kumar A, Singh K, Sharma A. Treatment of dermatitis in dogs associated with Malassezia pachydermatis. Indian Veterinary Journal. 2002; 79(7):730-2.
57. Jasmin P, Schroeder H, Briggs M, Last R, Sanquer A, editors. Assessment of the efficacy of a 3% chlorhexidine shampoo in the cont-rolof elevated cutaneous Malassezia populations and associated clinical signs (Malassezia dermatitis) in dogs. Proceedings ofthe 19th Annual Congress of the ESVD ECVD, Tenerife 2003.
58. Reme C, Cadot P Holzapfel G, Jasmin P Efficacy of combined topical therapy with keratoregulating shampoo and lotion in the management of keratoseborroeic disorders associated with Malassezia proliferation in dogs. 2003;13(suppl. 1):264.
59. Carlotti D, Reme C, editors. Efficacy of a soothing astringent topicalspray for the management of Malassezia pododermatitis in dogs:a preliminary open-label clinical trial. Proceedings of the 47th-Annual British Small Animal Veterinary Association Congress, 2004.
60. Hammer KA, Carson CF, Riley TV. In vitro activities of ketoconazole, econazole, miconazole, and Melaleuca alternifolia (tea tree) oil against Malassezia species. Antimicrobial agents and chemotherapy. 2000;44(2):467-9. Epub 2000/01/20.
61. Nenoff P, Haustein UF, Brandt W. Antifungal activity of the essential oil of Melaleuca alternifolia (tea tree oil) against pathogenic fungi in vitro. Skin pharmacology : the official journal of the Skin Pharmacology Society. 1996;9(6):388-94. Epub 1996/01/01.
62. Carson CF, Hammer KA, Riley TV. Melaleuca alternifolia (Tea Tree) oil: a review of antimicrobial and other medicinal properties. Clin Microbiol Rev. 2006;19(1):50-62.
63. Hammer KA, Carson CF, Riley TV. In-vitro activity of essential oils, in particular Melaleuca alternifolia (tea tree) oil products, against Candida spp. Journal of Antimicrobial Chemotherapy. 1998;42:591-5.




Назад в раздел


















